产品货号:
YTB7120
中文名称:
T7 DNA连接酶
英文名称:
T7 DNA Ligase
产品规格:
150kU|600kU|3000kU
发货周期:
1~3天
产品价格:
询价
本制品是表达纯化获得的一种来源于T7噬菌体的、ATP依赖的双链DNA连接酶,并且对于粘性末端的连接效率远远高于平末端。
与T3和T4 DNA Ligase不同,T7 DNA Ligase仅可催化双链DNA相邻粘性末端5'磷酸和3'羟基磷酸二酯键的形成,但不能有效催化平末端双链DNA的连接,加入大于或等于20%的PEG6000可以适当提高该酶的平末端DNA连接活性。因此在平末端和粘性末端双链DNA底物同时存在,且仅需连接粘性末端双链DNA的分子生物学实验中,T7 DNA Ligase是理想的选择。

限制性内切酶切DNA片段的克隆,双链DNA和接头的连接,线性双链DNA的环化,双链DNA的缺刻修复、定点突变和Transcription Activator-Like Effector Nucleases(TALEN)的DNA片段的Golden Gate Assembly、粘端特异性连接等。

纯化自携带编码T7噬菌体DNA ligase的E.coli重组菌株。

一个活性单位是指20μL反应体系中,25℃条件下,30分钟内使100ng λDNA的HindIII切割片段连接50%所需的酶量。

| 组分 | 150kU | 600kU | 3000kU |
| T7 DNA Ligase (3kU/μL) | 50μL | 200μL | 1mL |
| 2×Reaction Buffer | 500μL | 2mL | 10mL |
保存:-20℃,有效期2年。

10mM Tris-HCl,50mM KCl,1mM DTT,0.1mM EDTA,50% Glycerol,pH7.4@25℃。

2×Reaction Buffer:
132mM Tris-HCl,20mM MgCl2,2mM DTT,2mM ATP,15% PEG6000,pH7.6@25℃。

不含除T7 DNA Ligase之外的其它种类的DNA连接酶,不含DNA内切酶和外切酶,不含RNA酶,不含磷酸酯酶。

在不含有PEG6000的反应体系中65℃孵育10分钟。

- ATP是T7 DNA Ligase发挥催化活性所必需的辅助因子,而不是像E.coli DNA Ligase以NAD作为辅助因子的。
- T7 DNA Ligase不能有效催化平末端双链DNA片段的连接,对于平末端双链DNA的连接建议使用T4 DNA Ligase。
- T7 DNA Ligase的催化底物是双链DNA,不能用于单链DNA或RNA的连接反应。
- T7 DNA Ligase的反应体系中含有7.5% PEG6000。如果实验体系中不能加入PEG6000,可考虑自行配制不含PEG6000的连接反应缓冲液,或者使用T4 DNA Ligase的连接缓冲体系,但T7 DNA Ligase连接酶在T4 DNA Ligase的连接缓冲体系中的活性会降低约10倍。
- 反应体系所需的超纯水推荐使用无菌无酶超纯水。

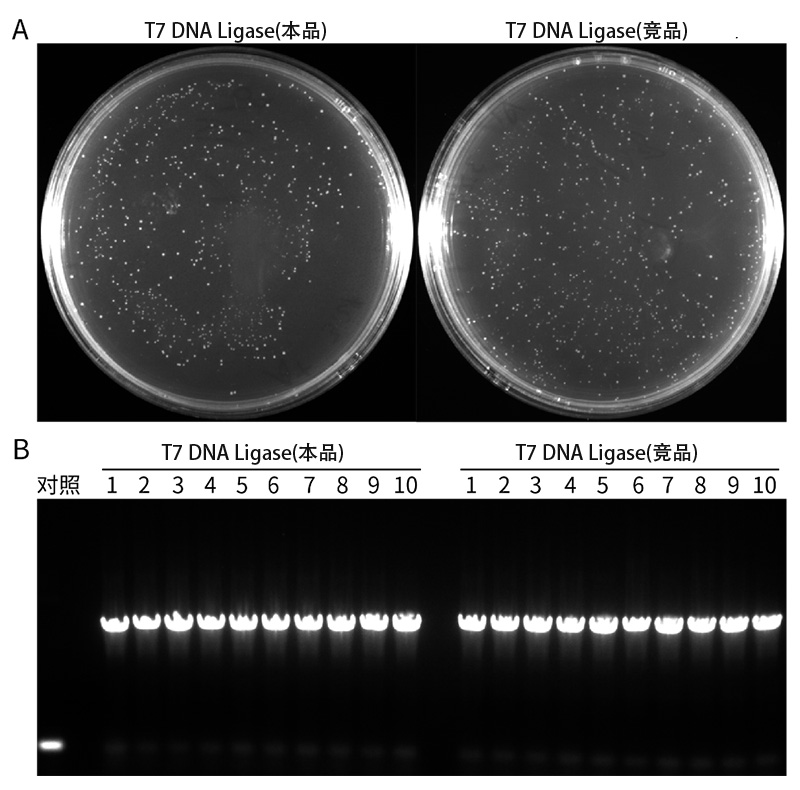
图1.T7 DNA Ligase用于进行双链DNA粘性末端连接的效果图。
A.百奥莱博与N公司的T7 DNA Ligase催化产生的重组连接产物转化DH5α感受态后涂LB平板的实测效果图。利用BalbFusion DNA聚合酶,使用一端带有Hind III酶切识别位点,另一端带有Xba Ⅰ酶切识别位点的引物对靶基因进行PCR扩增,随后使用HindIII限制性内切酶/XbaI限制性内切酶对1kb的PCR产物进行双酶切,获得两端带有粘性末端的双链线性DNA分子,作为T7 DNA Ligase催化连接反应的底物。在20μL反应体系(66mM Tris-HCl,10mM MgCl2,1mM DTT,1mM ATP,7.5% PEG6000,pH7.6@25℃)中,分别加入50ng经PCR扩增及Hind III/Xba I双酶切产生的两端带有粘性末端的双链DNA片段,和经Hind III/Xba I双酶切线性化的pUC18载体混合(PCR片段与pUC18载体的摩尔比为3:1),加入10μL的2×Reaction Buffer以及1μL的本制品或N公司的T7 DNA Ligase,然后用水补至20μL,25℃孵育30分钟进行连接。反应结束后,取5μL连接产物转化DH5α感受态细胞。
B.菌落PCR鉴定T7 DNA Ligase重组连接构建得到的克隆。实验结果表明,本品与N公司的竞品克隆阳性率一致,具有相当的连接粘性末端双链线性DNA的效果。菌落PCR使用的是pUC18的通用测序引物M13 forward sequencing primer(5′-GTAAAACGACGGCCAGT-3′)和M13 reverse sequencing primer (5′-CAGGAAACAGCTATGAC-3′)。本图仅供参考,实际检测效果可能有所不同。

- 参考下表在冰浴中配制反应体系(以20μL体系为例):
成分 用量 2×Reaction Buffer 10μL 载体DNA XμL(0.020pmol) 带插入DNA片段 YμL(0.060pmol) 超纯水 (9-X-Y)μL T7 DNA Ligase(3kU/μL) 1μL 总体积 20μL - 建议按照DNA片段与线性化载体摩尔比3:1的比例进行连接反应。
- T7 DNA Ligase建议最后添加。
- 建议按照DNA片段与线性化载体摩尔比3:1的比例进行连接反应。
- 移液器吹打混匀,低速离心使粘附在管壁上的液体沉降至管底。
- 反应条件:25℃(或室温)孵育15~30分钟。
- 反应完成后需将连接产物立即置于冰上,取5μL左右连接产物转化到50μL感受态细胞中。剩余样品可选择性的保存于-20℃。
- 不能进行热失活,热失活会显著降低连接产物的转化效率。
- 为检测连接效率,也可将反应后的产物进行琼脂糖凝胶或聚丙烯凝胶电泳,拍照观察并分析连接效果。如果需要从琼脂糖凝胶中回收DNA样品,推荐使用琼脂糖凝胶DNA回收试剂盒。
- 不能进行热失活,热失活会显著降低连接产物的转化效率。

- T7 DNA Ligase只能催化粘性末端双链DNA分子的连接。那么T7 DNA Ligase可以连接多少长度的粘性末端?
T7 DNA Ligase可以有效催化2bp或更长粘性末端的连接,不能连接1bp的粘性末端。通常情况下,T7 DNA Ligase一般不能连接平末端双链DNA;但当反应体系中含有非常高浓度的PEG6000 (20~30% w/v)时,T7 DNA Ligase对平末端双链DNA也具有一定的连接活性。 - T7 DNA Ligase可以和不含PEG6000的缓冲液一起使用吗?
可以。如果实验体系中不能加入PEG6000,我们推荐自行配制仅去除了PEG6000的2×Reaction Buffer。 - 使用T7 DNA Ligase进行连接反应时,有哪些潜在的因素会导致转化失败?
有以下因素会导致连接反应失败:- 反应体系中缺少ATP或Mg2+会导致连接失败。缓冲液中的ATP,保存时间过长可能会逐渐降解导致此问题的发生。建议使用新鲜提供的缓冲液或适量补充ATP到反应体系中,以保证连接效率。
- 反应体系中存在高盐或EDTA会导致连接失败。建议纯化连接底物,去除干扰。
- CIP,BAP或SAP等磷酸酶在去磷酸化过程中没有完全失活。建议按照推荐的步骤完全去除磷酸酶。
- 反应体系中DNA的浓度过高会导致只产生线性DNA。建议连接体系中DNA的总浓度保持在1~10μg/mL的范围内。
- 加入太多的连接产物转化到感受态细胞中会导致转化的失败。建议加入1~5μL的连接产物转化到50μL的感受态细胞中。
- 含有PEG6000的情况下过长时间的连接,会逐渐产生抑制转化的大片段DNA,降低转化效率。
- 连接产物在电穿孔前没有进行纯化。缓冲液中存在的盐和PEG6000均会抑制电穿孔实验。建议使用纯化柱对连接产物进行纯化,以尽可能去除缓冲液。
- 空载体酶切不完全,会导致获得的克隆基本都是空载体而缺少含有插入片段的目的克隆。
- 反应体系中缺少ATP或Mg2+会导致连接失败。缓冲液中的ATP,保存时间过长可能会逐渐降解导致此问题的发生。建议使用新鲜提供的缓冲液或适量补充ATP到反应体系中,以保证连接效率。
- 在解决转化效率问题时还应考虑哪些因素?
- 感受态细胞不能存活或转化效率过低。建议使用新的感受态细胞。
- 连接的DNA是否含有大肠杆菌拮抗的反向重复序列或串联重复序列。
- 插入的DNA片段如果来自哺乳动物或者植物,可能含有能够被多种大肠杆菌株所降解的甲基化胞嘧啶。建议使用mcrA、mcrBC和mrr缺乏的大肠杆菌株。
- 构建的载体过大(>10kb),不能使用化学转化的方式,建议使用电穿孔转化方式。
- 感受态细胞不能存活或转化效率过低。建议使用新的感受态细胞。
- 在限制性内切酶消化过程中存在哪些问题会导致T7 DNA Ligase的连接反应或后续的转化失败?
- 酶切效率不高,没有实现完全酶切。如果切割发生在一个PCR片段的末端,需要确保有足够的酶切保护碱基,建议在酶切位点外侧额外增加6个碱基。并建议使用对照底物测试限制酶的活性。
- 限制性内切酶没有完全失活。如果限制性内切酶不能热失活,可纯化DNA以尽可能地去除限制性内切酶。
- 限制性内切酶切割DNA片段或载体时产生了星活性。建议凝胶电泳检测DNA,适当减少限制性内切酶的使用量或减少酶切反应时间。
- DNA或限制性内切酶中含有破坏DNA片段末端的核酸外切酶或磷酸酶时,建议纯化DNA。
- 酶切效率不高,没有实现完全酶切。如果切割发生在一个PCR片段的末端,需要确保有足够的酶切保护碱基,建议在酶切位点外侧额外增加6个碱基。并建议使用对照底物测试限制酶的活性。
- 使用T7 DNA Ligase时应加入多少DNA?
为促进环化DNA连接产物的形成,提高转化效率,加入的总DNA浓度应在1~10μg/mL之间,以实现有效连接。同时建议按照插入DNA片段与线性化载体摩尔比3:1的比例加入到反应体系中。摩尔比低于2:1会降低连接效率;摩尔比高于6:1会导致多个片段的插入。如果底物DNA的浓度无法确定,可尝试多种比例的连接。
相关搜索:T7 DNA连接酶,DNA连接酶,双链DNA,粘性末端,粘末端,T7 DNA Ligase



