产品货号:
YTB4628
中文名称:
T4 DNA快速连接酶
英文名称:
Instant T4 DNA Ligase
产品规格:
40kU|200kU
发货周期:
1~3天
产品价格:
询价
Instant T4 DNA Ligase是T4 DNA连接酶的升级版本,可以快速高效催化粘端或平端双链DNA或RNA的5'-P末端和3'-OH末端之间以磷酸二酯键结合,该催化反应需ATP作为辅助因子。同时T4 DNA快速连接酶可以修补双链DNA、双链RNA或DNA/RNA杂合双链中的单链缺刻。

Instant T4 DNA Ligase常用于DNA片段和载体、linker或adaptor等的连接。也可用于缺刻修复及Ligase介导的RNA检测。

本T4 DNA快速连接酶由大肠杆菌表达,表达基因为T4嗜菌体T4 DNA Ligase基因的突变体。

一个活性单位是指在20μL反应体系中,16℃温度下,30分钟内使λDNA(HindIII)连接50%所需的酶量。

| 组分 | 40kU | 200kU |
| Instant T4 DNA Ligase (1kU/μL) | 40μL | 200μL |
| 10×Ligation Buffer | 200μL | 1mL |
保存:-20℃,有效期1年。

200U等于1个Weiss unit,以Weiss unit计,本制品的包装分别为200U和1000U。

20mM Tris(pH7.5),50mM KCl,1mM DTT,0.1mM EDTA,50% (v/v) glycerol。

10×Ligation Buffer:
400mM Tris(pH7.8),100mM MgCl2,100mM DTT,10mM ATP。

不含DNA内切酶、外切酶和磷酸酯酶,不含RNA酶,满足常规连接反应要求。

- 65℃孵育10min可以导致Instant T4 DNA Ligase失活;
- NaCl或KCl浓度大于200mM时会强烈抑制Instant T4 DNA Ligase。

Instant T4 DNA Ligase和T4 DNA Ligase分别进行平末端连接后,连接产物转化感受态细胞后涂板获得的LB平板的实测效果和菌落PCR鉴定结果参考图1。
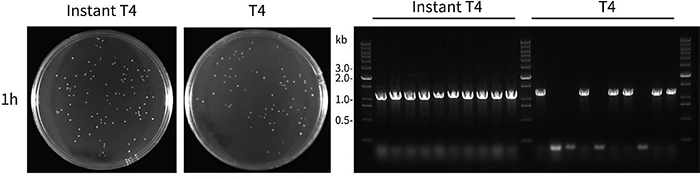
图1.Instant T4 DNA Ligase和T4 DNA Ligase的平末端连接实测效果图。如图所示,左侧为将Instant T4 DNA Ligase和T4 DNA Ligase分别用于平端连接后转化DH5α感受态细胞后涂板获得的LB平板的实测效果图,右侧为菌落PCR鉴定的结果。在20μL反应体系中,将SmaI单酶切线性化并用热敏性热敏性南极磷酸酶去除末端磷酸根的载体pUC18,与PCR扩增的1100bp双平端DNA片段混合(载体与DNA片段的摩尔比为1:3),然后加入2μL的10×Ligation Buffer,0.5μL的Instant T4 DNA Ligase或T4 DNA Ligase,并用水补足至20μL,分别在16℃孵育1h后,取10μL转化到100μL的DH5α感受态细胞中。实验结果表明,Instant T4 DNA Ligase连接1小时得到的克隆数相当,Instant T4 DNA Ligase连接1h的阳性率可达100%,而T4 DNA Ligase连接1h的阳性率约为60%。菌落PCR引物为M13 forward sequencing primer (5'-GTAAAACGACGGCCAGT-3')和M13 reverse sequencing primer (5'-CAGGAAACAGCTATGAC-3')。实际检测效果会因实验条件的不同而存在差异,图中效果仅供参考。

- PCR产物或酶切片段和普通载体的连接:
- 取1~2μg载体酶切过夜,或至少酶切3-5h以上。尽量确保酶切充分,否则后续会导致产生很多自连的克隆。
- 载体酶切或去磷酸化处理完毕后,可以使用试剂盒进行纯化,例如磁珠法PCR产物DNA纯化试剂盒或PCR产物DNA纯化试剂盒。也可以采用常规的酚氯仿抽提乙醇沉淀方法纯化载体。对于酶切产生较大片段(大于50~60bp)的情况推荐采用切胶回收的方式。
- 对于PCR产物:PCR产物凝胶电泳后,切胶回收预期大小的DNA片段。凝胶中DNA片段的回收可以使用试剂盒进行操作,例如磁珠法DNA胶回收试剂盒或琼脂糖凝胶DNA回收试剂盒。也可以采用反复冻融等方法回收DNA片段。
- 对于回收的PCR产物或其它需酶切的DNA片段,用适当内切酶酶切,随后纯化酶切产物。
- 这一步的酶切不必酶切特别充分,通常酶切效率能达到80~90%以上即可。即本步骤的酶切通常酶切1~2小时即可。酶切产物可使用试剂盒进行纯化,例如磁珠法PCR产物DNA纯化试剂盒或PCR产物DNA纯化试剂盒。也可以采用常规的酚氯仿抽提乙醇沉淀方法纯化。
- 取约25~100ng经过酶切和纯化的载体,加入3倍摩尔数的待插入片段。参考下表设置连接反应体系。
- 很多时候由于载体量和待插入片段的量都比较少,在回收后很难定量。此时可以根据回收前电泳条带的亮度进行大致的估计。通常以DNA分子量标准的某一条带为参考,估计或通过灰度半定量目的条带和该参考条带的亮度的比例关系。然后再按照预计的纯化或凝胶回收时的得率计算出最终得到的载体量和待插入片段量的比例关系。超纯水推荐使用无菌无酶超纯水。
- 通常每个反应使用0.2~0.5μL连接酶已经足够,如果希望进一步提高连接效率,可以把连接酶的用量提高至1μL。
成分 用量 Vector 50~100ng Insert 3:1 (mole ratio) VS Vector 10×Ligation Buffer 2μL 超纯水 至20μL Instant T4 DNA Ligase 0.2~0.5μL - 很多时候由于载体量和待插入片段的量都比较少,在回收后很难定量。此时可以根据回收前电泳条带的亮度进行大致的估计。通常以DNA分子量标准的某一条带为参考,估计或通过灰度半定量目的条带和该参考条带的亮度的比例关系。然后再按照预计的纯化或凝胶回收时的得率计算出最终得到的载体量和待插入片段量的比例关系。超纯水推荐使用无菌无酶超纯水。
- 用移液器轻轻吹打混匀或轻微Vortex混匀,室温离心数秒,使液体积聚于管底。
- 16℃孵育1~18h,或20~25℃孵育连接1-2h。
- 同时兼容双平端和双粘端DNA片段连接。
- 通常16℃孵育1~4h即可以获得较好的连接效果。
- 同时兼容双平端和双粘端DNA片段连接。
- 随后即可直接取连接产物用于转化感受态细菌。
- PCR产物和T载体的连接:
- PCR产物凝胶电泳后,切胶回收预期大小的DNA片段。凝胶中DNA片段的回收可以使用例如磁珠法DNA胶回收试剂盒或琼脂糖凝胶DNA回收试剂盒等试剂盒,也可以采用反复冻融等方法回收DNA片段。
- 按照T载体的说明书取适量T载体,加入3倍摩尔数的待插入片段。参考下表设置连接反应体系。
- 很多时候由于载体量和PCR产物的量都比较少,在回收后很难定量。此时可以根据回收前电泳条带的亮度进行大致的估计。通常以DNA分子量标准的某一条带为参考,估计或通过灰度半定量目的条带和该参考条带的亮度的比例关系。然后再按照预计的纯化或凝胶回收时的得率计算出最终得到的载体量和PCR产物的量的比例关系。
- 通常每个反应使用0.2~0.5μL连接酶已经足够,如果希望进一步提高连接效率,可以把连接酶的用量提高至1μL。
成分 用量 T vector As recommended Insert 3:1 (mole ratio) VS Vector 10×Ligation Buffer 2μL 超纯水 至20μL Instant T4 DNA Ligase 0.2~0.5μL - 很多时候由于载体量和PCR产物的量都比较少,在回收后很难定量。此时可以根据回收前电泳条带的亮度进行大致的估计。通常以DNA分子量标准的某一条带为参考,估计或通过灰度半定量目的条带和该参考条带的亮度的比例关系。然后再按照预计的纯化或凝胶回收时的得率计算出最终得到的载体量和PCR产物的量的比例关系。
- 用移液器轻轻吹打混匀或轻微Vortex混匀,室温离心数秒,使液体积聚于管底。
- 16℃孵育1-18h,或20~25℃孵育连接1-2h。
- 通常16℃孵育1-4h即可以获得较好的连接效果。
- 随后即可直接取连接产物用于转化感受态细菌。
- PCR产物凝胶电泳后,切胶回收预期大小的DNA片段。凝胶中DNA片段的回收可以使用例如磁珠法DNA胶回收试剂盒或琼脂糖凝胶DNA回收试剂盒等试剂盒,也可以采用反复冻融等方法回收DNA片段。
- Linker或miRNA/RNAi/sgRNA等小RNA表达用DNA片段和载体的连接:
- 载体的酶切和纯化同步骤1a和1b。
- Linker或miRNA、RNAi、sgRNA等小RNA表达用DNA片段的退火可以选择适当的DNA退火缓冲液,例如DNA寡核苷酸退火缓冲液,进行退火反应。
- 长度大于8bp的Linker或退火的小RNA表达用DNA片段,可以按照5:1至10:1的比例和载体进行连接反应。例如载体为0.03pmol,则插入片段可以为0.15至0.3pmol。长度小于8bp的linker,比例需调整为10:1以上。
- 除插入片段的用量外,随后按照步骤1e-1h进行。
- 载体的酶切和纯化同步骤1a和1b。
- DNA自身环化的连接:
参考步骤1e,待插入片段换成适量的水即可。其余步骤按照步骤1f-1h进行。 - 其它类型的DNA片段连接参考上述方法进行。

- 连接反应后转化效率很低或阳性克隆非常少。
- 可能感受态细菌转化效率太低,用质粒作为阳性对照同时检测感受态的转化效率。
- 可以尝试提高载体或插入片段的纯度,也可以考虑适当提高载体或插入片段的用量。对于平端连接需注意适当延长连接时间。
- 可能载体酶切不够充分,用未经连接的载体转化作为阴性对照。
- 用存放DNA的溶液进行转化,作为阴性对照,检测感受态细菌是否存在问题。
- 可能感受态细菌转化效率太低,用质粒作为阳性对照同时检测感受态的转化效率。
相关搜索:T4 DNA快速连接酶,DNA连接酶,超快速,Instant T4 DNA Ligase



