
产品货号:
HR8217
中文名称:
高纯度外泌体提取试剂盒(细胞培养上清)
英文名称:
High purity Exosomes Extraction Kit for cell culture supernatant
产品规格:
20T|50T
发货周期:
1~3天
产品价格:
询价
本试剂盒适用于从各种原代或传代培养细胞培养上清样品中提取总外泌体。不需要超速离心,仅需通过简单的常规离心即可从样本中获取大量结构完整的外泌体,提取的外泌体可根据实验目的用于后续的多种实验,应用范围广泛。
传统的体外培养的细胞中分离和提取exosome的主要方法是超速离心法,这种方法缺点是耗时耗力,往往需要30~70个小时,每次最多只能处理6个样品,需要大量的起始材料,而且产量不高。
我公司的外泌体快速提取试剂盒系列产品,可以通过简单离心快速高效获得高纯度外泌体颗粒。本试剂盒提取的外泌体完好无缺,能用于各种功能研究、蛋白分析及RNA分析、电镜分析、NTA粒径分析等下游应用实验。
本试剂盒按每个样本处理4mL细胞培养上清计,每个50T试剂盒大约可以用于提取200mL细胞培养上清。如果需要处理大量的细胞培养上清,将提取液按细胞培养上清体积的1:4加入细胞培养上清即可。

外泌体是活细胞分泌的来源于晚期核内体(也称为多囊泡体)的膜性小囊泡,直径约为30~150nm,天然存在于血液、唾液、尿液和母乳等各种体液中,研究发现,Exosome内含有与细胞来源相关的蛋白质、mRNA和microRNA,并且exosome能够通过生物屏障,在细胞间传递功能性核酸分子,从而发挥各种生物学功能。
外泌体囊泡已经成为细胞间通讯的重要介质,参与原核生物和高等真核生物细胞之间的生物信号传递,以调节不同范围的生物过程。外泌体囊泡的病理生理作用开始在包括癌症、感染性疾病和神经变性疾病在内的疾病中得到充分认识,显现了外泌体作为疾病的早期诊断、治疗干预的潜在新靶点的巨大应用前景。此外,未修饰和工程化的外泌体囊泡可能在大分子药物递送中具有应用价值。

- 使用方便,无需超速离心,省时省力;
- 纯度高,富集量大,应用范围广;
- 获取的Exosome结构和功能完整;
- 稳定性好,便于运输,便于保存。

| 组份 | 20T | 50T |
| 组份A:外泌体提取液A | 20mL | 50mL |
| 组份B:外泌体保存液B | 15mL | 30mL |
| 组分C:外泌体纯化离心管C | 4套 | 10套 |
保存:2~8℃,有效期1年。

移液器,离心机,PBS,HBSS,纯水

- 可以根据自己实验需要加入其它蛋白酶抑制剂。
- 以下以4mL培养基为例,实际操作时按培养基和提取液A体积比4:1使用即可。
- 不同细胞分泌的外泌体数量差异极大,请根据实际情况选择培养基样品的量,根据下游应用和参考文献确定。条件允许的情况下采用尽可能多的细胞培养上清。
- 一般巨噬细胞、淋巴细胞、造血细胞、胰腺癌细胞等分泌外泌体较多,其它细胞样本建议每个样培养基上清用量不少于8mL。常规的细胞样本最佳培养上清上样量为15~20mL及以上,条件允许的情况下采用尽可能多的细胞培养上清。
- 条件允许的情况下可以将细胞培养上清浓缩后再提取外泌体。
- 在收获细胞时,应确定死亡细胞不超过5%。细胞凋亡/死亡过程中会释放大量大小不等的囊泡,它们在外泌体的提取过程中会污染活细胞产生的外泌体。
- 已经分离好的外泌体样本如果需要进行电镜观察,只能冰上或4℃保存,存放时间不超过两天,注意不可冷冻保存,否则可能会影响电镜观察效果。

一、外泌体提取
- 收集4mL待提取的培养基样品,置2~8℃保存。
注:冻存样品置水浴锅解冻后置2~8℃保存。 - 将样品在4℃条件下,3000×g离心15分钟。弃沉淀,收集上清。
- 小心将上清移入另一干净离心管中。
- 将样品在4℃条件下,10000×g离心20分钟。弃沉淀,收集上清。
- 小心将上清移入另一干净离心管中。
- 在4mL上清中加入1mL提取液A,盖紧离心管盖,上下颠倒混匀1分钟左右,使液体充分混匀。
注:试剂A使用前请充分混匀。 - 置2~8℃冰箱静置过夜。
注:静置保存时间不少于10小时。 - 在4℃条件下,10000×g离心60分钟。
- 小心移除上清,收集沉淀。
注:
① 尽可能吸干上清。
② 吸取时小心,防止吸掉沉淀。 - 取500μL外泌体保存液将沉淀重悬,用移液器轻轻吹打混匀,得到外泌体重悬液,进行下列外泌体纯化步骤操作。
二、外泌体纯化:
- 清洗外泌体纯化离心管:
- 用缓冲液或纯水进行预清洗。
- 离心管中的过滤膜一旦湿润后应避免变干。如果在预清洗后不是立即使用,则让液体保留在滤膜上,直到使用。
注:
① 可以在外泌体提取步骤中需要使用前再清洗。
② 重复使用时要仔细检查管壁上有没有裂纹。
- 用缓冲液或纯水进行预清洗。
- 纯化步骤:
- 将外泌体纯化离心管内管插入所提供的的一个微量离心管中。
- 向内管中加入过500μL的外泌体沉淀重悬液样本,并盖上盖子。
注:
① 用吸头伸入内管中时,必须防止碰到滤膜,以免戳破滤膜。
② 加外泌体悬液或Buffer到内管时,可以用蓝吸头;但从内管底部吸取纯化好的外泌体时,必须用黄吸头。 - 将盖好盖子的外泌体纯化离心管放入离心转子中,让盖子的连接带朝着转子的中央;用一个类似的离心管平衡。
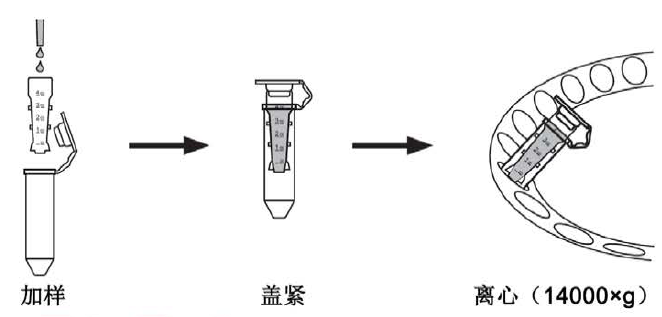
- 以5000~8000×g离心约10~15分钟。离心至大约剩余50μL~100μL液体。
注:
① 离心至大约剩余50μL~100μL液体即可,不要过度浓缩。
② 如果外泌体样本的起始浓度很高,请监控离心过程,以免样本过度浓缩,过度浓缩会导致沉淀,这也可能带来样本损失。第一次做新样品时,可以离心机分钟后观察剩余液体大概体积。
③ 建议将滤过液吸入1.5mL带盖的离心管(自备)中保存,一直保留到外泌体的样品分析测试完成。避免吸头戳破滤膜导致外泌体损失。
④ 影响流速的因素包括样本浓度、相对离心力、离心转子的角度以及温度。500μL样本的典型离心时间大约是10至20分钟。大部分样本在离心开始后的前5至10分钟发生过滤纯化,但在离心10至30分钟后才能达到最低的纯化液体积(20μL)。
⑤ 可以将浓缩的外泌体用PBS或HEPES等缓冲液(根据下游实验选择)稀释,再次离心至大约剩余50μL~100μL,这样的外泌体纯度将再次提高,残余的外源蛋白质和核酸更少。 - 离心结束后将整个离心管从离心机中取出,取出内管。
注:外泌体可能会有少量的吸附损失,吸附损失取决于外泌体浓度、与过滤纯化内管表面接触的温度和时间。为了最大限度降低损失,离心后请立即回收过滤后的外泌体样本。 - 为了回收纯化后的外泌体,将内管倒过来插在另一个干净的微量离心管中。放在离心机中,让打开的盖子朝着转子的中央;用一个类似的离心管进行平衡。
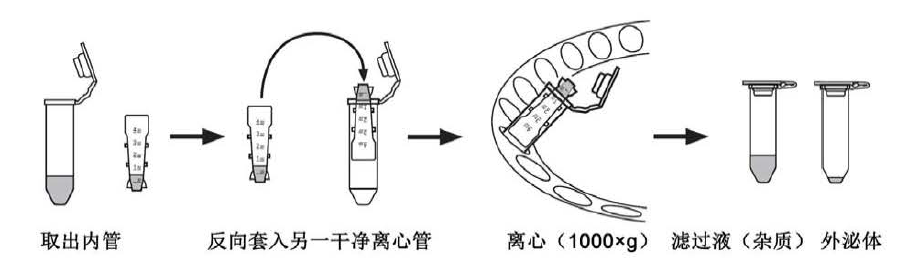
- 以1000×g离心2分钟,使纯化后的外泌体样本从纯化内管转移到收集管中。
注:
① 要达到理想的回收效果,请尽早进行倒置离心。
② 也可不倒置离心,直接用移液器吸出内管中的样品。
③ 从内管管底吸出纯化好的外泌体时,必须用黄吸头。
④ 用吸头伸入内管中时,必须防止碰到滤膜,以免戳破滤膜。 - 吸取收集管中的液体,即得到外泌体样品纯品。
注:
① 可以根据下游实验需要,用相应的缓冲液稀释保存外泌体。
② 也可直接用于蛋白提取。
③ 将外泌体样本-80℃保存或直接用于下游应用。
④ 外泌体短期保存可以置于2~8℃即可,一周以上长期不用置于-80℃保存。
⑤ 保存前可以用0.22μm或0.35μm滤器过滤除菌。 - 用纯水或缓冲液洗涤内管和收集管,继续纯化下一个样品。
注:
① 洗涤内管时,加入400μL PBS缓冲液或其他缓冲液,用吸头反复吹打,吸掉缓冲液即可。
② 用PBS洗涤3~4次。
③ 用吸头伸入内管中时,必须防止碰到滤膜,以免戳破滤膜。
④ 每个离心管内管建议重复使用5次,不要超过10次。
⑤ 加外泌体悬液或Buffer到内管时,可以用蓝吸头;但从内管管底吸取纯化好的外泌体时,必须用黄吸头。
⑥ 如果使用过的离心管需要长期保存,可以按下列方法清洗和保存离心管内管。
- 将外泌体纯化离心管内管插入所提供的的一个微量离心管中。
- 外泌体纯化离心管清洗和保存:
- 使用后用水冲洗干净;
- 内管加入超纯水500μL,5000g离心5分钟;
- 吸净内管中的水,加入500μL 0.1M NaOH,5000g离心20分钟;
- 用0.1M NaOH浸泡24小时;
- 用水冲洗干净;
- 用无菌水浸泡2~8℃保存;
- 外管用自来水洗净后,用超纯水冲洗干净,晾干。
注:
① 1个月不用的话,直接用100mM的NaOH保存!更长时间的话加0.02%的叠氮钠。
② 再次用前,用纯水充分冲洗干净,然后根据下游实验需要,用相应的缓冲液平衡。
- 使用后用水冲洗干净;

- 培养细胞时,如何去除血清来源的外泌体?
多数情况下,细胞在体外培时养需要血清,而血清中一般都含有外泌体,为避免血清对细胞外泌体的污染,可采用以下3种方法:- 选择商品化的无外泌体血清进行细胞培养;
- 选择无血清培养基进行细胞培养;
- 将细胞培养用的血清通过100000g超速离心10小时以上以去除血清外泌体。
- 选择商品化的无外泌体血清进行细胞培养;
- 无外泌体血清培养基(或者无血清培养基)在什么时候使用?
细胞在正常含血清的培养基中培养一定的时间后,细胞融合度约为60%~70%时,移去原有含血清的培养基,换成新鲜的无外泌体血清培养基(或者无血清培养基),继续培养24-48h,细胞融合度达到80%~95%左右时收取上清,该上清液即可用于提取外泌体。 - 准备做细胞外泌体siRNA的NGS测序,初始样品量需要准备多少?
普通肿瘤细胞系建议使用40mL以上的初始样品量。由于某些细胞(如悬浮细胞、干细胞、神经细胞等)中外泌体含量比较低,建议先将上清浓缩,准备40mL以上的浓缩液再使用本试剂盒提取外泌体。 - 如何鉴定提取的外泌体?
通常使用透射电镜检测(形态)、粒径检测(大小)、外泌体标志蛋白Western blot检测等方法鉴定提取的外泌体。 - 外泌体WB标志蛋白用什么?
在进行WB检测时,通常检测外泌体标志蛋白为CD63、CD9、CD81、TSG101、ALIX、HSP70等。 - 进行外泌体WB鉴定时有什么内参蛋白可供选择?
没有,该检测属于定性检测。 - 蛋白浓度低?
很多细胞外泌体量不够下游应用,在条件允许情况请尽可能加大培养上清的上样量。
处理部分样本时可能没有裂解完全,导致蛋白浓度低。请选择高质量的蛋白裂解液或蛋白提取试剂盒。 - 抽提得到的RNA浓度低?
很多细胞外泌体量不够下游应用,在条件允许情况请尽可能加大培养上清的上样量。 - 外泌体纯化管内管膜会因为离心时间过长而变干吗?
不会,因为内管有死体积,总会有溶液残留在内管中。死体积大约10~20μL。 - 可以重复使用过滤管吗?
可以重复使用。如果使用、清洗、保存得当,可以反复使用多次,但是超过8次重复使用后过滤膜有破损风险,注意使用过程中尽量避免尖锐物品戳到膜。离心力不要过大。 - 外泌体在纯化时出现了沉淀,如何改进?
如果过滤过快或者过度浓缩都有可能引起沉淀。如果样品的外泌体浓度很高,建议降低最终的外泌体浓度,保留更多的液体。
对于因过滤速度敏感而导致的沉淀,建议的改进方法是:- 离心力降低30%~50%
- 在过滤过程中取出过滤管,用枪头反复吹吸几次。
- 离心力降低30%~50%
- 有时候用外泌体纯化离心管连水都离不下来,可能是什么原因?
如果出现这种情况,可能是过滤膜的孔被堵住。请先用0.1M NaOH清洗再离心。最后用缓冲液或纯水再次清洗后甩干。清洗后的滤膜应立即使用,如暂时不用,请保持湿润状态,避免重新干燥。 - 说明书中推荐在室温下进行例行,考虑到外泌体的稳定性,是否可以在4℃进行离心?
可以,但是低温可能会增加外泌体样品的粘性,导致流速减慢,建议可将离心时间延长。
相关搜索:高纯度外泌体提取试剂盒(细胞培养上清),外泌体提取纯化试剂盒



