
产品货号:
BTN111208
中文名称:
植物线粒体纯化试剂盒
英文名称:
Plant Mitochondria Purification Kit
产品规格:
5次
发货周期:
1~3天
产品价格:
询价
植物线粒体是重要的植物细胞器,负责ATP的产生。此外植物很多重要的特性(如雄性不育)也跟线粒体相关,是母系遗传研究的重要材料。对植物线粒体进行生化和遗传研究都需要进行线粒体纯化。本制品就是专门用于植物细胞线粒体纯化的试剂盒。
产品特点:
1.即用型试剂盒,用户不需要单独配制各种溶液。
2.提供粗提和精提两种操作方案,粗提利用常规台式冷冻离心机的差速分离原理进行线粒体粗提,所得线粒体含少量其他细胞器污染,可用于后续的SDS-PAGE,Western,ELSIA和蛋白组分析,也可以用于PCR级别的线粒体DNA和RNA提取。
3.精提利用冷冻超速离心(离心力达40000g)制备的密度梯度来将粗提制备的线粒体和其他细胞成分进一步分开,得到线粒体精提液,适用于后续的偶联分析、体外线粒体蛋白合成、线粒体成份定位等精细实验。也可用于后续的SDS-PAGE、Western、ELSIA、蛋白组分析和测序级别的线粒体DNA和RNA提取。
4.本制品足够5次提取,每次可处理10g绿色植物组织(可得1~2.5mg左右线粒体)或20g非绿色植物组织(可得2~5mg左右的线粒体)。
产品组成:
保存条件:常温,有效期一年。
自备试剂:超纯水,可能需要5MKOH调pH,如果需要去除细胞核DNA,还需要自备25mMMgCl2溶液、0.5MEDTA溶液、DNase干粉和另购更多洗涤液。
使用方法:
注意:线粒体膜对温度高度敏感,所以整个操作必须在冰上或者在冷室进行,所用植物组织,器皿和溶液均需要在4℃预冷。任何情况下线粒体的温度都不要超过4℃。
一:选择组织
1.植物组织不同,线粒体产率不同,请以下表为参考:
2.一般纯化最好选用用黄化苗。如果用绿色组织(如叶片),需将植物提前放在暗室至少3天以降低淀粉含量,否则淀粉颗粒将干扰线粒体的纯化。
3.一次实验需要40mL匀浆液、约90mL洗涤液和35mL密度梯度离心介质(配制方式是一次性将9.8g (8.7mL) Percoll加入到26.3mL离心介质溶液中,充分混匀后得到35mL密度梯度离心介质)。这三种溶液用前均需要加入BSA干粉使其终浓度为0.1%(100mL溶液加0.1g BSA干粉,轻柔颠倒混匀或搅拌溶解后放冰上预冷待用)。每次实验用多少配多少,不要预先将所有BSA干粉加入,否则容易长菌。
二:线粒体粗提操作流程
1.将10g的绿色植物组织(如去叶脉后的嫩叶子,愈伤组织)或20g干净的非绿色植物组织(如发芽组织、根、块茎等)浸泡在冰水中10分钟,用纸吸干液体后浸泡在预冷的40mL匀浆液(需先加0.1% BSA)中,在浸泡状态下剪成1cm2大小的碎片。注意:如果样品可分成多组平行处理,得到线粒体粗提物后再汇集,否则线粒体产率将急剧降低。
2.将匀浆液和其中的植物组织碎片转移到Waring匀浆器中,中速匀浆3次,每次15秒,每次之间间隔10秒以便让碎片沉淀下来到刀片处。也可使用研磨法。具体操作是将匀浆液和其中的植物组织碎片转移到预冷的研钵中,研磨3~4分钟。
注意:植物组织匀浆后释放的物质会使匀浆液酸化,降低pH,而线粒体对pH变化非常敏感,因此建议匀浆后用pH试纸检测匀浆液的pH,如果低于7.0,必须用自备的5M KOH将pH调到7.0以上才进入下一步。
3.用带柄尼龙筛过滤匀浆液,穿透液可通过预冷的漏斗收集到预冷的50mL的塑料离心管中。带柄尼龙筛可以洗干净后可以反复使用。
4.在低速固定角度冷冻离心机上4℃ 1000g离心5分钟,沉淀为未破碎的细胞、破碎细胞的碎片、细胞核和淀粉颗粒,上清含线粒体。小心转移上清到新的预冷的50mL塑料离心管中。
5.将装上清的离心管在水平冷冻离心机上4℃ 12000g离心20分钟,弃上清液,所得棕绿色沉淀即为纯化的线粒体粗提物。有时沉淀底部还有白色的淀粉沉淀,属于正常现象。
6.加入10mL预冷的洗涤液(需先加0.1% BSA,下同)中,用软毛笔轻柔重悬线粒体沉淀(如果最底下有白色淀粉沉淀,需要避免重悬之)。不能剧烈震荡,否则线粒体容易破裂。
7.将线粒体重悬液转移到新的50mL离心管中,再加入30mL预冷的洗涤液(终体积为40mL)中,4℃ 1000g离心5分钟。线粒体将在上清中。
8.将上清转移到新的预冷的50mL离心管中,4℃ 12000g离心20分钟,沉淀为线粒体。小心弃上清。到此步时,线粒体回收率一般在15~30%。
9.在沉淀中加入2mL预冷的洗涤液。用软毛笔轻柔重悬,得到线粒体粗提液。如果有平行提取,可将最多4管线粒体沉淀重悬在2mL洗涤液中。线粒体粗提液中线粒体的回收率一般在45~75%。
10.所得线粒体粗提液含其他细胞器(如类囊体膜,质体,过氧化物酶体,乙醛酸循环体,或细菌)污染,但可直接用于PCR级线粒体DNA和RNA的提取、呼吸链功能测定、蛋白浓度测定和线粒体精提。如果需要长期保存,则可以在线粒体重悬液中加入1/20体积的自备DMSO,混匀后分成0.5mL/管,然后放-80℃保存。如此保存的线粒体酶活性和膜完整性在几年内都不会发生变化。
三:细胞核DNA的去除(纯化测序级的线粒体DNA才需要进行此操作。本制品不提供相关试剂,实验步骤仅供参考)
11.预留50μL线粒体粗提液做对照,在约2mL剩余的线粒体粗提液中加入40μL25mM的MgCl2,再加入200μg DNase干粉或溶液(总量为200μg即可),混匀后冰上放置60分钟降解DNA。取少量样品(如50μL)在PCR仪器中加热到95℃变性10分钟灭活DNase,再取其中的10μL和10μL预留的样品一起进行细胞核基因专一性PCR,如果DNase处理的样品没有扩增,而预留样品有扩增,则表明DNA去除比较干净(达到PCR检测的极限),则进入下一步。如果未去除干净,则继续在冰上放置,直到PCR检测不到细胞核DNA。
12.加入0.32mL预冷的自备0.5M的EDTA溶液和40mL预冷的洗涤液。
13.4℃ 1000g离心5分钟,将上清转移到新的预冷的50mL离心管中,4℃ 12000g离心20分钟,沉淀为去除细胞核DNA的线粒体。重悬在2mL洗涤液中。
四:线粒体精提操作方案(需要40000g的超速冷冻离心机)
14.在50mL预冷的塑料离心管中先后加入35mL预冷的密度梯度离心介质(配制方法见第三步,用前需先加0.1% BSA)。
15.将2mL线粒体粗提物重悬液铺在密度梯度离心介质上。
16.在超速水平离心机上4℃ 40000g离心45分钟,最上层为黄色或橙色的质体带(如果材料是绿色植物,此带将是绿色),其下的白色不透明的带即为线粒体,管底沉淀为过氧化物酶体。其示意图如下:
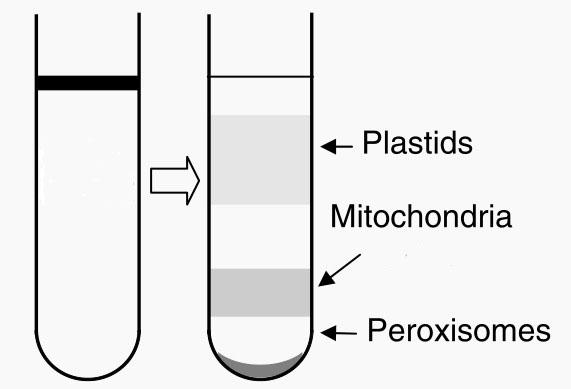
17.用广口吸管(可将1mL蓝抢头中间剪断后使用)收集线粒体带,注意避开其上的质体带过氧化物酶体沉淀,估计所取含线粒体溶液的体积。
18.在15~20分钟的时间内缓慢加入至少4倍体积的预冷的洗涤液。
19.转入50mL塑料管离心管中,在冷冻离心机上4℃ 15000g离心20分钟,沉淀为线粒体。
20.将线粒体沉淀用软毛笔小心重悬在至少4倍体积的预冷的洗涤液中,在冷冻离心机上4℃ 15000g离心20分钟,弃上清,沉淀即为洗涤后的线粒体精提物。到此步时,线粒体回收率一般在5~15%。
21.将精提的线粒体重悬在1mL预冷的洗涤液中。重悬的线粒体可以立即使用,在冰上最多可放置5~6小时。如果需要长期保存,则可以在线粒体重悬液中加入1/20体积的DMSO,混匀后分成0.5mL/管,然后放-80℃保存。如此保存的线粒体酶活性和膜完整性在几年内都不会发生变化。
五:线粒体后续处理(本制品不提供相关试剂,实验步骤仅供参考)
22.DNA提取:离心得线粒体沉淀,再按常规的SDS-蛋白酶K酶解,酚氯仿抽提,乙醇-盐沉淀的方法制备线粒体DNA。也可以用细菌DNA提取的试剂盒制备DNA。
23.RNA提取:离心得线粒体沉淀,再按常规的Trizol方法制备线粒体RNA。
24.总蛋白提取:按细菌总蛋白提取方法。
25.线粒体内膜,外膜、基质纯化:请自备方法。
26.其他功能检测:请自备方法。
相关搜索:植物线粒体纯化试剂盒,Plant Mitochondria Purification Kit
产品特点:
1.即用型试剂盒,用户不需要单独配制各种溶液。
2.提供粗提和精提两种操作方案,粗提利用常规台式冷冻离心机的差速分离原理进行线粒体粗提,所得线粒体含少量其他细胞器污染,可用于后续的SDS-PAGE,Western,ELSIA和蛋白组分析,也可以用于PCR级别的线粒体DNA和RNA提取。
3.精提利用冷冻超速离心(离心力达40000g)制备的密度梯度来将粗提制备的线粒体和其他细胞成分进一步分开,得到线粒体精提液,适用于后续的偶联分析、体外线粒体蛋白合成、线粒体成份定位等精细实验。也可用于后续的SDS-PAGE、Western、ELSIA、蛋白组分析和测序级别的线粒体DNA和RNA提取。
4.本制品足够5次提取,每次可处理10g绿色植物组织(可得1~2.5mg左右线粒体)或20g非绿色植物组织(可得2~5mg左右的线粒体)。
产品组成:
| 组分 | 编号 | 规格 |
| 匀浆液 | BTN111208A | 250mL |
| 洗涤液 | BTN11208B | 250mL×2 |
| 离心介质溶液 | BTN11208C | 150mL |
| Percoll | 17-0891-09 | 50mL |
| BSA干粉 | 048-46-8 | 10g |
| 带柄尼龙筛 | 1只 | |
| 软毛笔 | 1只 |
保存条件:常温,有效期一年。
自备试剂:超纯水,可能需要5MKOH调pH,如果需要去除细胞核DNA,还需要自备25mMMgCl2溶液、0.5MEDTA溶液、DNase干粉和另购更多洗涤液。
使用方法:
注意:线粒体膜对温度高度敏感,所以整个操作必须在冰上或者在冷室进行,所用植物组织,器皿和溶液均需要在4℃预冷。任何情况下线粒体的温度都不要超过4℃。
一:选择组织
1.植物组织不同,线粒体产率不同,请以下表为参考:
| 植物组织种类 | 线粒体产率 | 说明 |
| 根和块茎 | 0.3mg/10g | 如土豆,红薯等 |
| 黄化苗(下胚轴、子叶、胚芽鞘) | 2~5mg/10g | 多酚含量低于叶片 |
| 光合作用的叶片和子叶 | 1~2.5mg/10g | 需放置在暗处3天 |
2.一般纯化最好选用用黄化苗。如果用绿色组织(如叶片),需将植物提前放在暗室至少3天以降低淀粉含量,否则淀粉颗粒将干扰线粒体的纯化。
3.一次实验需要40mL匀浆液、约90mL洗涤液和35mL密度梯度离心介质(配制方式是一次性将9.8g (8.7mL) Percoll加入到26.3mL离心介质溶液中,充分混匀后得到35mL密度梯度离心介质)。这三种溶液用前均需要加入BSA干粉使其终浓度为0.1%(100mL溶液加0.1g BSA干粉,轻柔颠倒混匀或搅拌溶解后放冰上预冷待用)。每次实验用多少配多少,不要预先将所有BSA干粉加入,否则容易长菌。
二:线粒体粗提操作流程
1.将10g的绿色植物组织(如去叶脉后的嫩叶子,愈伤组织)或20g干净的非绿色植物组织(如发芽组织、根、块茎等)浸泡在冰水中10分钟,用纸吸干液体后浸泡在预冷的40mL匀浆液(需先加0.1% BSA)中,在浸泡状态下剪成1cm2大小的碎片。注意:如果样品可分成多组平行处理,得到线粒体粗提物后再汇集,否则线粒体产率将急剧降低。
2.将匀浆液和其中的植物组织碎片转移到Waring匀浆器中,中速匀浆3次,每次15秒,每次之间间隔10秒以便让碎片沉淀下来到刀片处。也可使用研磨法。具体操作是将匀浆液和其中的植物组织碎片转移到预冷的研钵中,研磨3~4分钟。
注意:植物组织匀浆后释放的物质会使匀浆液酸化,降低pH,而线粒体对pH变化非常敏感,因此建议匀浆后用pH试纸检测匀浆液的pH,如果低于7.0,必须用自备的5M KOH将pH调到7.0以上才进入下一步。
3.用带柄尼龙筛过滤匀浆液,穿透液可通过预冷的漏斗收集到预冷的50mL的塑料离心管中。带柄尼龙筛可以洗干净后可以反复使用。
4.在低速固定角度冷冻离心机上4℃ 1000g离心5分钟,沉淀为未破碎的细胞、破碎细胞的碎片、细胞核和淀粉颗粒,上清含线粒体。小心转移上清到新的预冷的50mL塑料离心管中。
5.将装上清的离心管在水平冷冻离心机上4℃ 12000g离心20分钟,弃上清液,所得棕绿色沉淀即为纯化的线粒体粗提物。有时沉淀底部还有白色的淀粉沉淀,属于正常现象。
6.加入10mL预冷的洗涤液(需先加0.1% BSA,下同)中,用软毛笔轻柔重悬线粒体沉淀(如果最底下有白色淀粉沉淀,需要避免重悬之)。不能剧烈震荡,否则线粒体容易破裂。
7.将线粒体重悬液转移到新的50mL离心管中,再加入30mL预冷的洗涤液(终体积为40mL)中,4℃ 1000g离心5分钟。线粒体将在上清中。
8.将上清转移到新的预冷的50mL离心管中,4℃ 12000g离心20分钟,沉淀为线粒体。小心弃上清。到此步时,线粒体回收率一般在15~30%。
9.在沉淀中加入2mL预冷的洗涤液。用软毛笔轻柔重悬,得到线粒体粗提液。如果有平行提取,可将最多4管线粒体沉淀重悬在2mL洗涤液中。线粒体粗提液中线粒体的回收率一般在45~75%。
10.所得线粒体粗提液含其他细胞器(如类囊体膜,质体,过氧化物酶体,乙醛酸循环体,或细菌)污染,但可直接用于PCR级线粒体DNA和RNA的提取、呼吸链功能测定、蛋白浓度测定和线粒体精提。如果需要长期保存,则可以在线粒体重悬液中加入1/20体积的自备DMSO,混匀后分成0.5mL/管,然后放-80℃保存。如此保存的线粒体酶活性和膜完整性在几年内都不会发生变化。
三:细胞核DNA的去除(纯化测序级的线粒体DNA才需要进行此操作。本制品不提供相关试剂,实验步骤仅供参考)
11.预留50μL线粒体粗提液做对照,在约2mL剩余的线粒体粗提液中加入40μL25mM的MgCl2,再加入200μg DNase干粉或溶液(总量为200μg即可),混匀后冰上放置60分钟降解DNA。取少量样品(如50μL)在PCR仪器中加热到95℃变性10分钟灭活DNase,再取其中的10μL和10μL预留的样品一起进行细胞核基因专一性PCR,如果DNase处理的样品没有扩增,而预留样品有扩增,则表明DNA去除比较干净(达到PCR检测的极限),则进入下一步。如果未去除干净,则继续在冰上放置,直到PCR检测不到细胞核DNA。
12.加入0.32mL预冷的自备0.5M的EDTA溶液和40mL预冷的洗涤液。
13.4℃ 1000g离心5分钟,将上清转移到新的预冷的50mL离心管中,4℃ 12000g离心20分钟,沉淀为去除细胞核DNA的线粒体。重悬在2mL洗涤液中。
四:线粒体精提操作方案(需要40000g的超速冷冻离心机)
14.在50mL预冷的塑料离心管中先后加入35mL预冷的密度梯度离心介质(配制方法见第三步,用前需先加0.1% BSA)。
15.将2mL线粒体粗提物重悬液铺在密度梯度离心介质上。
16.在超速水平离心机上4℃ 40000g离心45分钟,最上层为黄色或橙色的质体带(如果材料是绿色植物,此带将是绿色),其下的白色不透明的带即为线粒体,管底沉淀为过氧化物酶体。其示意图如下:

17.用广口吸管(可将1mL蓝抢头中间剪断后使用)收集线粒体带,注意避开其上的质体带过氧化物酶体沉淀,估计所取含线粒体溶液的体积。
18.在15~20分钟的时间内缓慢加入至少4倍体积的预冷的洗涤液。
19.转入50mL塑料管离心管中,在冷冻离心机上4℃ 15000g离心20分钟,沉淀为线粒体。
20.将线粒体沉淀用软毛笔小心重悬在至少4倍体积的预冷的洗涤液中,在冷冻离心机上4℃ 15000g离心20分钟,弃上清,沉淀即为洗涤后的线粒体精提物。到此步时,线粒体回收率一般在5~15%。
21.将精提的线粒体重悬在1mL预冷的洗涤液中。重悬的线粒体可以立即使用,在冰上最多可放置5~6小时。如果需要长期保存,则可以在线粒体重悬液中加入1/20体积的DMSO,混匀后分成0.5mL/管,然后放-80℃保存。如此保存的线粒体酶活性和膜完整性在几年内都不会发生变化。
五:线粒体后续处理(本制品不提供相关试剂,实验步骤仅供参考)
22.DNA提取:离心得线粒体沉淀,再按常规的SDS-蛋白酶K酶解,酚氯仿抽提,乙醇-盐沉淀的方法制备线粒体DNA。也可以用细菌DNA提取的试剂盒制备DNA。
23.RNA提取:离心得线粒体沉淀,再按常规的Trizol方法制备线粒体RNA。
24.总蛋白提取:按细菌总蛋白提取方法。
25.线粒体内膜,外膜、基质纯化:请自备方法。
26.其他功能检测:请自备方法。
相关搜索:植物线粒体纯化试剂盒,Plant Mitochondria Purification Kit



