
本制品是一种通过探针法qPCR快速、有效、高灵敏、高特异性地定量检测各种生物制品样品中CHO宿主细胞残留基因组DNA含量的试剂盒。本制品为防污染型,含有优化比例的高品质UDG酶和dUTP,可有效消除PCR扩增过程中带来的产物污染问题造成的假阳性或CT值偏低。
本试剂盒提供了qPCR实验所需的预混液2×ByFast Probe qPCR Mix(含UDG)和特异性引物探针混合物。预混液包含了高质量、无CHO DNA残留的ByFast Taq DNA Polymerase和UDG酶、PCR Buffer、dNTPs、dUTP、稳定剂和镁离子等所有的通用组分;高纯度引物探针混合物以CHO基因组中高度特异性序列作为靶点所设计,二者结合可用于CHO DNA的超高灵敏度定量检测。此外,本试剂盒提供CHO DNA Control,作为阳性对照,用于检测试剂盒本身是否能正常工作及构建标准曲线。

中国仓鼠卵巢(Chinese hamster ovary,CHO)细胞是一种能够表达糖基化修饰及其它翻译后修饰的复杂蛋白的常用细胞株,适应能力强,适合大规模培养和重组蛋白的表达纯化,且相对于哺乳动物来说,染色体数目较少。CHO细胞广泛应用于遗传学、毒性筛选、营养和基因表达研究,是目前工业生产重组蛋白治疗药物最常用的哺乳动物宿主细胞。使用CHO细胞生产的生物制品在生产过程中,即使经过严格的纯化过程,仍然可能会有少量CHO细胞DNA片段的残留。这些残留的DNA片段可能具有生物危害性,当其残留水平过高时可能会导致炎症、致癌性和免疫调节障碍等风险增加。在许多国家和地区,药物注册和监管机构对生物制药产品中的宿主细胞DNA残留有严格的要求和限制。通过检测和控制宿主细胞DNA残留,可以评估生物制品的免疫原性风险和安全性。

- 本试剂盒能高效灵敏地检测CHO宿主细胞的残留DNA,最低检测限可至飞克(fg)。根据《中华人民共和国药典》2020年版第三部规定,检测DNA残留量的方法包括DNA探针杂交法、荧光染色法和定量PCR法,并且规定以细胞基质生产的生物制剂DNA残留量不能超过100pg/剂,以细菌或真菌基质生产的疫苗DNA残留量不能超过10ng/剂。本试剂盒基于中华人民共和国药典(2020年版)中外源性DNA残留量测定法中的定量PCR法,采用探针法qPCR,检测下限为3fg/μL,检测范围为3fg/μL~300pg/μL。
- 本试剂盒特异性强,HeLa细胞和E.coli细胞基因组DNA对CHO DNA残留检测无干扰。本试剂盒只检测CHO宿主细胞DNA,与其它物种DNA无交叉反应。
- 本试剂盒稳定性高,不同程度的碎片化DNA对CHO DNA残留检测基本无干扰。利用不同量微球菌核酸酶(MNase)将CHO DNA Control碎片化至不同程度,然后使用本试剂盒进行qPCR检测。结果显示,超过200bp的DNA,基本都会被检测到,不影响检测效果;但如果碎片化程度过于严重,导致200bp以下的DNA居多,会使DNA残留量检测值偏小。
- 本试剂盒重复性好。重复12次检测3pg/μL、30fg/μL CHO DNA的CT值见下表,CV值(变异系数)均小于5%。
重复次数 1 2 3 4 5 6 7 8 9 10 11 12 CV 3pg/μL CT值 26.68 26.65 26.49 26.28 26.38 26.5 26.48 26.11 26.20 26.13 26.05 26.72 0.84% 30fg/μL CT值 33.51 33.21 33.55 32.99 33.15 33.27 33.10 33.24 33.03 33.07 34.07 32.97 0.90% - 本试剂盒可搭配磁珠法宿主细胞残留DNA提取试剂盒用于样品提取。使用CHO DNA Control模拟样品的回收率测试结果见下表。
回收前残留DNA浓度 回收前体积 回收后残留DNA浓度 回收后体积 回收率 30fg/μL 100μL 30.10fg/μL 100μL 100.33% 3fg/μL 100μL 3.07fg/μL 100μL 102.33% - 回收率和样品浓度、体积、样品种类及实验操作等的不同而存在差异,表中数据仅供参考。
- 根据中华人民共和国药典(2020年版?三部)“外源性DNA残留测定法”中“第三法定量PCR”对于结果计算的要求,加标样品的回收率应在50%~150%之间。
- 回收率和样品浓度、体积、样品种类及实验操作等的不同而存在差异,表中数据仅供参考。

本制品提供了Low ROX和High ROX,广泛兼容于无需ROX和需要Low ROX或High ROX作为校正染料的荧光定量PCR仪。ROX的作用是用于校正与PCR无关的荧光波动,从而最大限度减少孔间差异。这种差异可能由多种因素引起,如移液误差及样品蒸发等。不同的荧光定量PCR仪对ROX的要求不同,请根据实际所用仪器选择含高浓度ROX (High ROX)、低浓度ROX (Low ROX)或不含ROX的2×ByFast Probe qPCR Mix。通常含高浓度ROX的2×ByFast Probe qPCR Mix也可以用于不需要ROX或需要低浓度ROX的荧光定量PCR仪。常用仪器所需ROX类型请参考如下表格。
| 添加ROX类型 | 适用PCR仪 |
| 不需添加 | Bio-Rad:CFX384,CFX96,MiniOpticon,iCycler IQ,MyiQ and iQ5; Eppendorf:Mastercycler ep realplex and realplex2 s; Qiagen/Corbett Rotor-Gene:6000; Roche LightCycler 480;Cepheid SmartCycler;Illumina Eco qPCR |
| Low ROX | ABI:7500 (Fast),ViiA 7,QuantStudio 6 and 7 Flex Systems; Stratagene:Mx3000P,Mx3005P and Mx4000; Qiagen/Corbett Rotor-Gene:3000; Bio-Rad/MJ:Chromo4,Opticon 2 and Opticon |
| High ROX | ABI GeneAmp 5700;ABI PRISM 7000,7700;ABI 7300,7900HT (Fast);ABI StepOne (Plus) |

| 组分 | 50T | 200T |
| 2×ByFast Probe qPCR Mix(含UDG) | 500μL | 2mL |
| 10×Primer/Probe Mix | 100μL | 400μL |
| 超纯水 | 500μL | 2mL |
| Dilution Buffer | 3mL | 12mL |
| CHO DNA Control(30ng/μL) | 50μL | 200μL |
| 50×Low ROX | 20μL | 80μL |
| 50×High ROX | 20μL | 80μL |
保存:-20℃,避免反复冻融,避光,有效期1年。

本试剂盒如果用于常规的96孔板qPCR检测(建议反应体系为20μL)或384孔板qPCR检测(建议反应体系为10μL),本制品小包装分别可以进行50次和100次检测,中包装分别可进行200次和400次检测。

- 本制品请在首次开启后建议立即使用完毕,或务必在无菌条件下对其适当分装并保存于-20℃,以免空气中的CHO DNA污染影响实验结果。
- 使用前请务必确保试剂完全融化,充分混匀后使用。混匀过程尽量避免产生气泡。
- 10×Primer/Probe Mix、50×Low ROX、50×High ROX中含有荧光染料,保存本制品或设置PCR反应体系时应避免强光照射,以尽量避免荧光淬灭问题。
- 经测试,本制品反复冻融10次对使用效果无显著影响,但仍需尽量避免反复冻融。反复冻融可能使产品性能下降。
- qPCR检测是超高灵敏度的检测,请尽量在标准的PCR实验室中进行检测。PCR反应设置区域须尽量避免各种可能的扩增产物的污染。虽然本制品为防污染型,但仍建议勿在PCR反应设置区域撕开PCR封板膜或打开PCR管盖,PCR产物宜密封后按扩增后产物要求处理,以避免超高浓度的PCR产物污染实验环境。
- 建议使用带滤芯的吸头配制PCR体系,这样可以最大限度的避免污染导致的假阳性。
- 建议使用低吸附的1.5mL离心管,样品回收率高。推荐无核酸酶离心管(1.5mL)。

- 需要用户自备的耗材、仪器和试剂:
- 具有FAM荧光通道的荧光定量PCR仪。
- DNase-free、RNase-free的吸头、低吸附离心管、荧光定量PCR用96孔板或384孔板、PCR板封板膜。
- 具有FAM荧光通道的荧光定量PCR仪。
- 样品准备:
选择合适的残留DNA样品制备试剂盒用于纯化提取生物制品的中间品、半成品和成品等中的CHO宿主细胞残留的基因组DNA,以此去除样品中抑制qPCR反应的物质。推荐使用磁珠法宿主细胞残留DNA提取试剂盒用于样品提取。- 由于本试剂盒灵敏度特别高,通常建议把样品制备的房间、qPCR反应体系配制的房间、处理扩增产物的房间按顺序分成3个房间,以避免出现假阳性。高浓度CHO DNA Control处理时须特别小心,仅稀释后的CHO DNA Control可以带入qPCR反应体系配制的房间。
- CHO DNA Control标准曲线设置:
用本试剂盒中提供的Dilution Buffer将CHO DNA Control(30ng/μL)进行梯度稀释,按照下表依次配制300pg/μL、30pg/μL、3pg/μL、300fg/μL、30fg/μL、3fg/μL的CHO DNA Control。Tube Number Dilution Methods Concentration ST0 10μL CHO DNA Control (30ng/μL) + 90μL Dilution Buffer 3ng/μL ST1 10μL ST0 + 90μL Dilution Buffer 300pg/μL ST2 10μL ST1 + 90μL Dilution Buffer 30pg/μL ST3 10μL ST2 + 90μL Dilution Buffer 3pg/μL ST4 10μL ST3 + 90μL Dilution Buffer 300fg/μL ST5 10μL ST4 + 90μL Dilution Buffer 30fg/μL ST6 10μL ST5 + 90μL Dilution Buffer 3fg/μL - CHO DNA Control (30ng/μL)和Dilution Buffer使用前置于冰上或4℃融化,Vortex充分混匀后使用。
- 每次稀释时应注意充分混匀。
- ST0管可置于-20℃保存,3个月有效;Dilution Buffer可置于4℃保存,至少一周有效,如果长时间不用,可以在-20℃保存。
- 样品加标回收质控ERC和阴性质控NEC的制备(选做):
根据实验需要,设置ERC (Extraction/Recovery Control),即在待测样品中加入已知浓度的标准品,与待测样品同时进行DNA提取,并进行qPCR检测,以计算待测样品的回收率,进而评估样品回收的效率。设置NEC (Negative Extraction Control),即仅含Dilution Buffer不含待测样品,与待测样品同时进行DNA提取,以评估检测系统本身、环境、人为等因素造成的误差及差异等。- ERC的制备:以制备加3pg CHO DNA量的ERC为例,取100μL待测样品和10μL 300fg/μL (即3pg)的ST4加入1.5mL离心管中,充分混匀,标记为ERC。
- NEC的制备:取100μL Dilution Buffer加入1.5mL离心管中,标记为NEC。
- ERC、NEC与待测样品须同批进行提取处理(同步骤2)。若样品中CHO DNA残留较高,需要稀释后再添加CHO DNA标准品,加标量在样品量的0.1~10倍范围内比较合适。
- ERC的制备:以制备加3pg CHO DNA量的ERC为例,取100μL待测样品和10μL 300fg/μL (即3pg)的ST4加入1.5mL离心管中,充分混匀,标记为ERC。
- qPCR反应体系的设置:
- 融解并混匀反应所需的各种溶液,置于冰浴上或冰盒内。
- 参考下表在室温或冰浴上设置qPCR反应体系(以96孔板,每孔反应体系为20μL为例)。下表中的Template为样品(纯化提取的或稀释后的)、无模板阴性对照(No Template Control,NTC)、标准品(CHO DNA Control)、ERC或NEC (可选)。NTC可使用Dilution Buffer。建议每次检测都设置NTC和Standard。
成分 用量 2×ByFast Probe qPCR Mix(含UDG) 10μL 10×Primer/Probe Mix 2μL 模板 2μL 50×ROX 0或0.4μL 超纯水 至20μL - 用移液器轻轻吹打混匀或轻微Vortex混匀,室温离心数秒,使液体积聚于管底。
- 将设置好的PCR反应管或PCR反应板置于荧光定量PCR仪上,开始PCR反应。
- 荧光检测通道的选择:CHO DNA Probe的荧光基团是FAM,可选择检测通道为FAM,淬灭基团是BHQ1,如果没有BHQ1,则选择无。
- 融解并混匀反应所需的各种溶液,置于冰浴上或冰盒内。
- qPCR反应程序:
本试剂盒建议采用如下的qPCR程序,本程序是以QuantStudio 6 Flex Systems荧光定量PCR仪为例:- UDG酶处理:50℃ 5min
- 预变性:95℃ 2min
- 变性:95℃ 15sec
- 退火/延伸:60℃ 30sec
- 重复步骤c和步骤d,总共40个循环
- 最后使用荧光定量PCR仪提供的软件分析检测结果
- UDG酶处理:50℃ 5min
- 结果的定性判断:
- 无模板阴性对照(NTC):FAM通道无典型扩增曲线,检测结果应为Undetermined或CT值≥38,或根据实验室自身验证结果设定具体标准;
- 标准曲线:R2≥0.98,扩增效率=90~110%;
- NEC的CT值大于标准曲线最低浓度的CT值;
- 样品浓度的计算:根据标准曲线有效范围内的CT值并结合标准曲线公式计算样品浓度(pg/μL或fg/μL)。请勿使用标准曲线有效范围之外的CT值计算待测样本的浓度;
- 加样回收率的计算:根据待测样品和加标样品(ERC)的检测结果计算加样回收率,加样回收率要求在50~150%之间。计算示例如步骤7f。
- 计算示例:
① 样品浓度计算示例:
使用磁珠法宿主细胞残留DNA提取试剂盒对100μL模拟待测样品以及对应的加标样品(即在待测样品基础上再添加一定量的标准品)进行制备操作,并使用CHO基因组DNA残留检测试剂盒检测样品浓度:复孔 待测样品CT值 待测样品lgCT 待测样品浓度 加标样品CT值 加标样品lgCT 加标样品浓度 1 36.95 0.58 3.81fg/μL 33.87 1.48 30.30fg/μL 2 37.74 0.35 2.24fg/μL 33.92 1.47 29.30fg/μL 3 37.76 0.34 2.21fg/μL 34.01 1.44 27.57fg/μL - 上表中用于计算样品浓度的标准曲线公式为:Y = -3.419X + 38.935,其中Y为CT值,X为该待测样品浓度的对数,斜率和Y轴截距是由荧光定量PCR仪自动生成。
根据步骤①中待测样品浓度及加标样品浓度,计算回收率:复孔 待测样品浓度 加标样品浓度 洗脱体积 加标量 回收率 1 3.81fg/μL 30.30fg/μL 100μL 3000fg 88.31% 2 2.24fg/μL 29.30fg/μL 100μL 3000fg 90.20% 3 2.21fg/μL 27.57fg/μL 100μL 3000fg 84.55% - 上表中用于计算加样回收率的公式为:(加标样品的浓度-待测样品的浓度)×洗脱体积/加标量。
- 无模板阴性对照(NTC):FAM通道无典型扩增曲线,检测结果应为Undetermined或CT值≥38,或根据实验室自身验证结果设定具体标准;

- 用于阳性对照检测的平均CT值、平均lgCT以及根据标准曲线计算所得的浓度见下表,扩增曲线及标准曲线参考图1。
Target 300pg/μL 30pg/μL 3pg/μL 300fg/μL 30fg/μL 3fg/μL NTC 平均CT值 19.4 22.84 26.24 29.72 32.78 36.25 Undetermined 平均lgCT 2.5 1.48 0.46 -0.57 -1.48 -2.51 - 浓度 315.25pg/μL 29.86pg/μL 2.91pg/μL 268.01fg/μL 32.94fg/μL 3.06fg/μL - 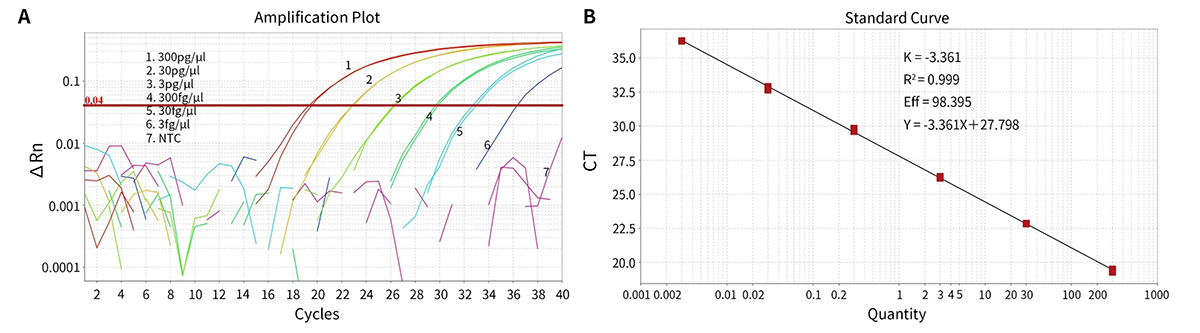
图1.本试剂盒用于不同浓度梯度的阳性对照的扩增曲线及标准曲线。将本试剂盒中的CHO DNA Control稀释至浓度分别为300pg/μL、30pg/μL、3pg/μL、300fg/μL、30fg/μL和3fg/μL,然后用本试剂盒进行qPCR检测。NTC,No Template Control。实测数据可能会因样品、检测仪器等的不同而存在差异,图中数据仅供参考。 - 本试剂盒只检测CHO宿主细胞DNA,与其它物种DNA无交叉反应(图2)。
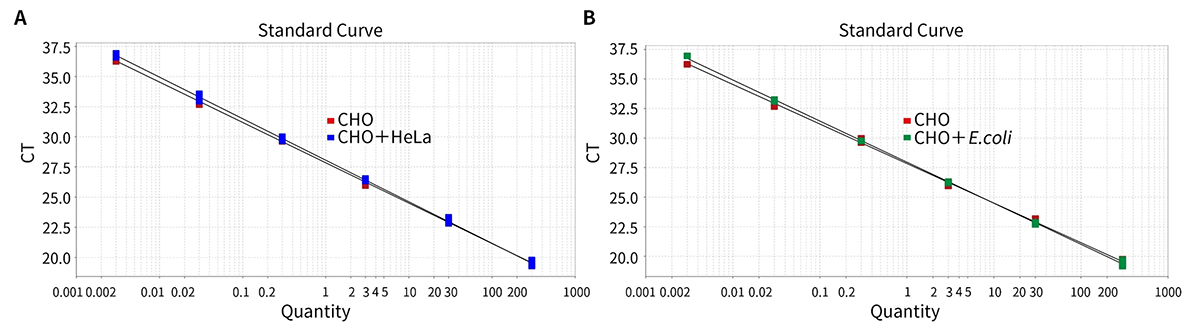
图2.本试剂盒检测不同浓度梯度阳性对照以及分别加入3ng HeLa或E.coli细胞基因组DNA的阳性对照的标准曲线。图中可见额外添加的HeLa或E.coli细胞基因组DNA,对于CHO DNA残留的检测无明细干扰。实测数据可能会因样品、检测仪器等的不同而存在差异,图中数据仅供参考。 - 本试剂盒检测不同碎片化程度DNA的扩增曲线及标准曲线参考图3,DNA碎片化处理的电泳结果参考图4。
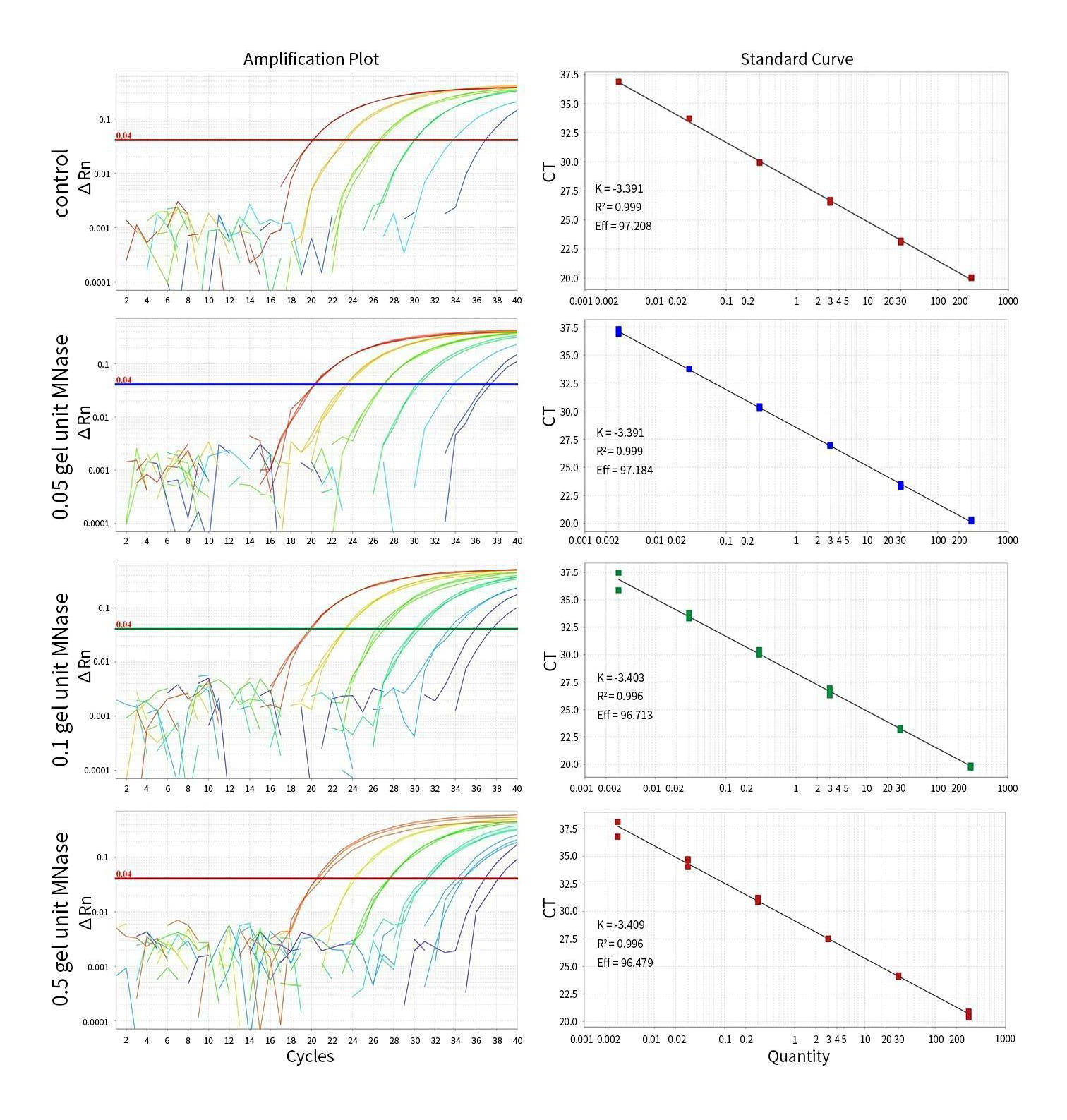
图3.本试剂盒对不同程度碎片化CHO DNA的检测效果图。CHO基因组DNA经不同量MNase碎片化处理后稀释成如图1中的各个浓度进行检测。实验结果显示,在0.05和0.1 gel unit的MNase处理后,检测结果和未碎片化处理的对照(control)基本一致;在0.5 gel unit的MNase处理后,由于大部分DNA在200bp以下(见图4),此时CT值明显增加,但在浓度达到30fg/μL时,检测出来的CT值通常仍能达到35以下。实测数据可能会因样品、检测仪器等的不同而存在差异,图中数据仅供参考。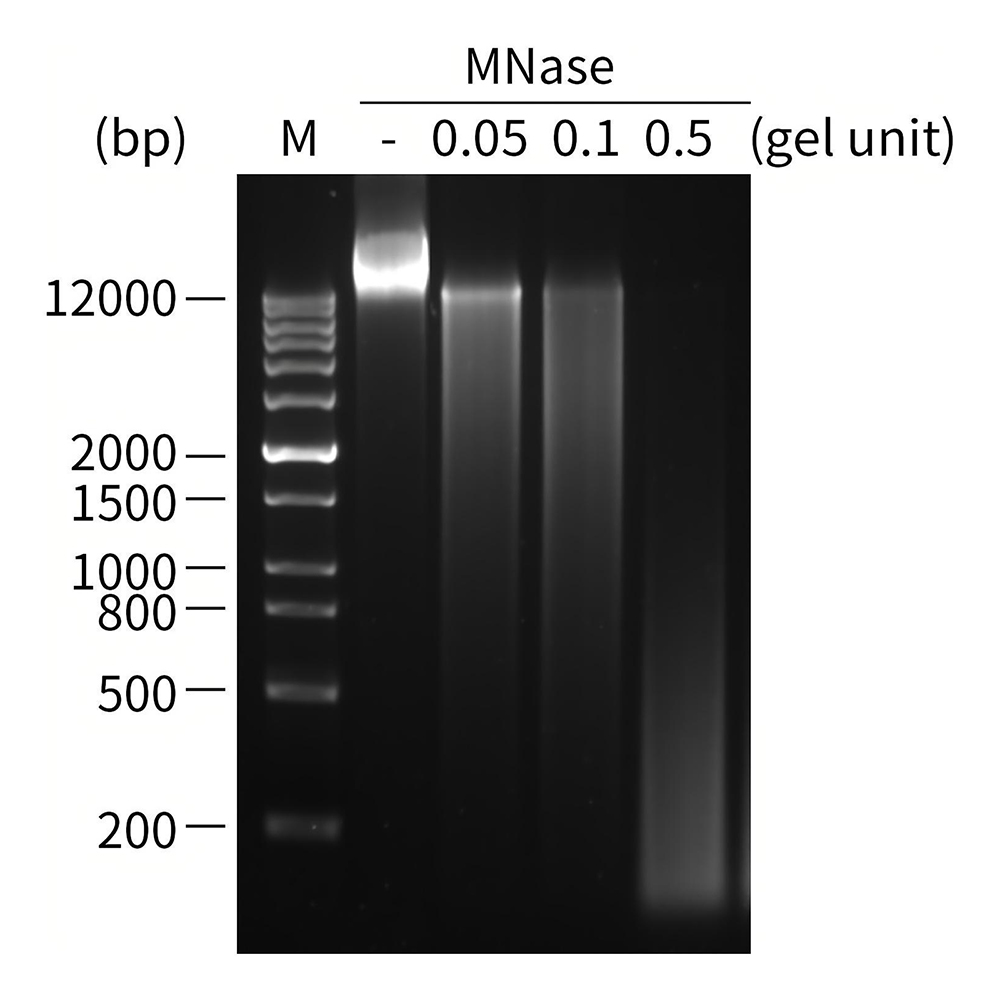
图4.不同量MNase碎片化处理的CHO基因组DNA的电泳图。CHO基因组DNA约0.5μg,37℃ 15分钟进行碎片化处理后终止反应。实测效果可能会因样品种类、检测仪器等的不同而存在差异,图中数据仅供参考。
相关搜索:CHO基因组DNA残留检测试剂盒(探针法qPCR),CHO基因组DNA,CHO宿主细胞基因组DNA,CHO DNA残留,探针法qPCR,CHO Genomic DNA Residue Probe qPCR Kit



