本制品是由高质量的链霉亲和素(Streptavidin)与高度交联的6%琼脂糖共价偶联而成,能够快速、高效、灵敏、特异性地与生物素(Biotin)标记的抗体、核酸、蛋白、多肽、凝集素等分子结合。主要用于分离纯化生物素标记的核酸、抗体、蛋白或相关复合物等,用于免疫沉淀(IP)、细胞分选、DNA-蛋白相互作用研究等。
Streptavidin的分子量为55kD,可以高度特异性地和生物素(Biotin)结合。Streptavidin和生物素的亲和常数为Kd =10-15M。Streptavidin是一个4聚体蛋白,可以同时结合4个生物素分子。Streptavidin的中文名为链霉亲和素,从Streptomyces adidinii中纯化获得,和鸡蛋清来源的Avidin (亲和素)在空间结构以及与生物素的亲和力方面具有高度的相似性。和Avidin不同的是,Streptavidin是一种非糖基化蛋白,并且基本不带电荷。Avidin的pI =~10.5,在中性pH条件下呈碱性。由于Streptavidin和Avidin相比在中性条件下不带电荷,因此Streptavidin的非特异性结合比Avidin低很多,这样检测时的非特异性背景就低很多。因此目前在生物素检测时通常使用Streptavidin替代Avidin。
链霉亲和素琼脂糖凝胶在生物医药领域内应用非常广泛,可以特异性地结合生物素标记的抗原或者抗体,作为免疫沉淀、细胞分选、ELISA等反应的载体;结合生物素标记的DNA或RNA片段,从细胞或组织提取物中分离特定的核酸-蛋白质复合物,用于蛋白质与核酸相互作用研究;结合生物素标记核酸探针,用于DNA、RNA杂交实验或mRNA的分离和纯化等;还可用于纯化单链生物素标记DNA寡核苷酸、分离生物素标记PCR产物等。本制品的实验流程参考图1。

| 产品内容 | 50%沉淀凝胶在特定的保护缓冲液 |
| 琼脂糖结构 | 6%交联琼脂糖 |
| 平均粒径 | 45~165μm |
| 偶联蛋白 | 链霉亲和素(Streptavidin) |
| 蛋白分子量 | ~55kDa(Streptavidin) |
| 蛋白浓度 | ≥2mg/mL |
| 结合能力 | ≥1mg生物素化抗体或dsDNA/mL; ≥200nmol游离生物素/mL; ≥8nmol生物素化寡核苷酸或多肽/mL |
| 特异性 | 生物素化配体 |
| 洗脱方法 | 用酸或SDS-PAGE上样缓冲液进行一次性洗脱 |
| 应用 | 生物素标记蛋白和核酸的纯化,IP,Co-IP,DNA-蛋白相互作用 |

- 结合量容量高:与同类的很多产品相比,本制品具有非常高的结合容量,对复杂样品中生物素标记的分子可以快速进行分离纯化。本制品中Streptavidin Agarose为50%的凝胶悬浊液,每毫升 Streptavidin Agarose沉淀中偶联有≥2mg高质量链霉亲和素蛋白,可结合约1~3mg生物素标记BSA,可高效地进行免疫沉淀等实验。
- 特异性强:本制品可特异性地结合生物素化的抗体、核酸、蛋白、多肽、凝集素等配体分子,获得的产物纯度高,可进一步用于Western、ELISA、Northern、qPCR、质谱分析等一系列后续的分析测试。

| 组分 | 1mL | 5mL | 20mL |
| 链霉亲和素琼脂糖凝胶 | 1mL | 5mL | 20mL |
| 说明书 | 1份 | ||
保存:-20℃,有效期1年。

本制品为50%凝胶悬液,包装体积为总体积,每毫升 本制品中共含有0.5mL凝胶沉淀物。如果每个用品使用50μL琼脂糖凝胶悬液,每毫升 本制品可以用于20个样品反应。

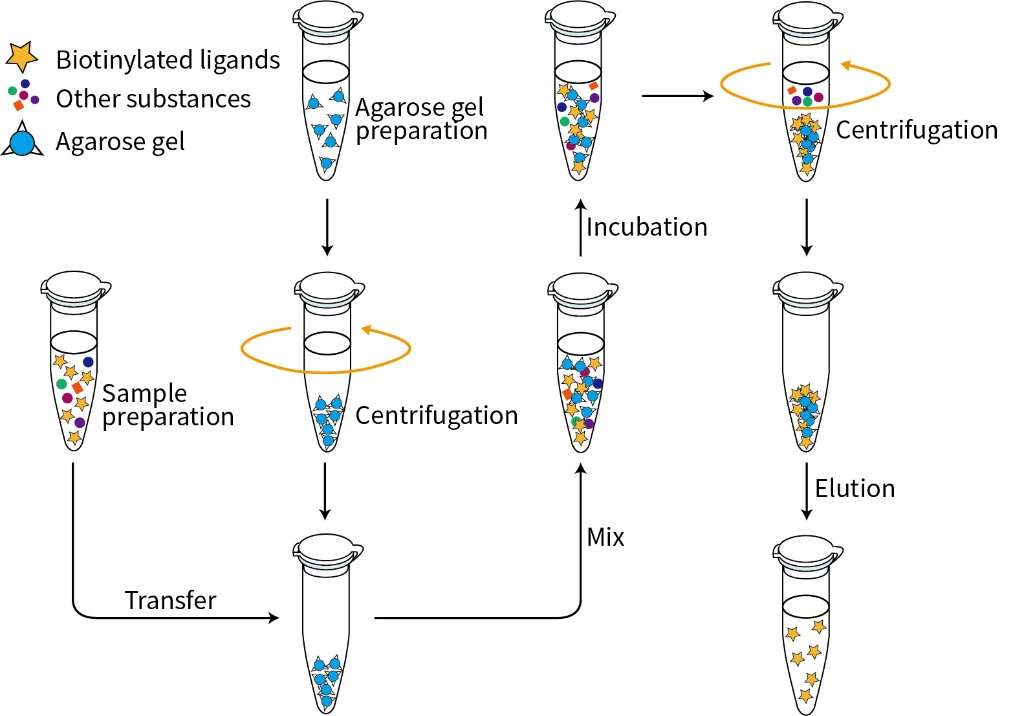
图1.链霉亲和素琼脂糖凝胶(Streptavidin Agarose)的实验流程图。

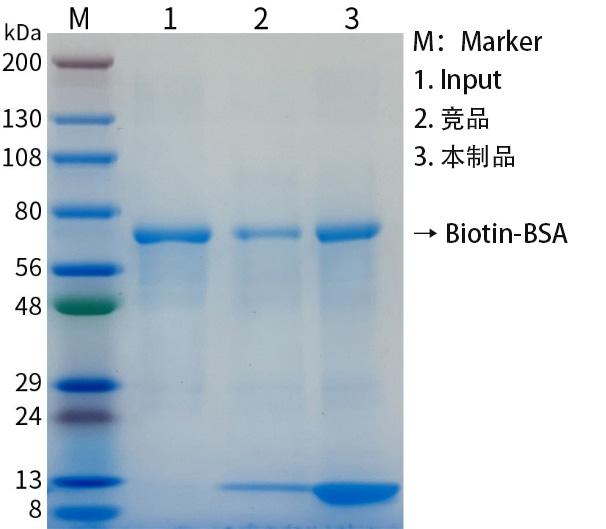
图2.链霉亲和素琼脂糖凝胶(Streptavidin Agarose)用于生物素标记BSA的结合效果图。泳道1为Input,即为生物素标记BSA (Biotin-BSA);泳道2为同类产品结合的Biotin-BSA;泳道3为本制品结合Biotin-BSA。结合后使用×SDS-PAGE Loading Buffer进行洗脱并进行SDS-PAGE。图中可见本制品能沉淀比竞品更多的Biotin-BSA,结合量接近总量(Input),并且本制品中偶联了更多的Streptavidin。图中约13kD处的条带为Streptavidin的单体。实际结果会因实验条件、检测仪器等的不同而存在差异,图中数据仅供参考。

- 本制品含有微量的防腐剂,使用前宜先用TBS等适当溶液洗涤凝胶3次,以充分消除防腐剂可能产生的干扰。
- 在免疫沉淀或纯化时,建议设计阳性和阴性对照组。
- 待结合分子的类型、大小及生物素标记方式和程度等都会影响结合效率,建议通过稀释法来确定每种具体应用的琼脂糖凝胶用量,同时可以考虑加大琼脂糖凝胶用量至待结合分子2~3倍摩尔数量以确保结合充分。
- 游离生物素会降低本琼脂糖凝胶的结合能力,因此在生物素标记蛋白或核酸后,需要用脱盐柱等方法去除多余的游离生物素。
- 蛋白样品收集后宜尽快完成纯化工作,并应始终放置在4℃或冰浴,以减缓蛋白降解或变性。为有效抑制蛋白降解,可以在蛋白样品中添加适量的蛋白酶抑制剂混合物,例如通用型蛋白酶抑制剂混合物、蛋白酶和磷酸酶抑制剂混合物(通用型,质谱兼容)、蛋白酶抑制剂混合物(哺乳动物样品专用)、蛋白酶和磷酸酶抑制剂混合物(哺乳动物样品专用)等。
- 如果离心不能完全除去蛋白样品中的不溶物,可以将样品溶液用0.45μm的滤膜过滤。酸性溶液洗脱或使用SDS-PAGE洗脱后的琼脂糖不可重复使用。为了尽量减少链霉亲和素的脱落,无论是手动操作还是自动操作,低pH洗脱步骤都不要超过10分钟。
- 高浓度的DTT、巯基乙醇、盐酸胍等对本制品与配体的结合可能有一定影响,但WB及IP细胞裂解液、RIPA裂解液(货号:YT609、YT610、YT611)或NP-40裂解液等都完全适用。

- 缓冲液的准备
参考下表,根据具体的实验用途配制相应的缓冲液。缓冲液 成分 应用 TBS Tris Buffered Saline (e.g.ST661/ST665) Prewash 2×Binding &Washing Buffer I 10mM Tris-HCl (pH7.5),1mM EDTA,2M NaCl,0.01%~0.1% Tween-20 for nucleic acid 1×Washing Buffer II PBS (pH7.4),0.05% Tween-20,with or without 0.01%~0.1% BSA for antibody/protein DNA/RNA Elution Buffer 95% formamide,10mM EDTA,pH8.2 for nucleic acid Acid Elution Buffer 0.1M Glycine (pH2.8) or 8M Guanidine·HCl (pH1.5) for antibody/protein Neutralization solution 1M Tris-HCl (pH8.5~9.5) for antibody/protein SDS-PAGE Loading Buffer SDS-PAGE Loading Buffer (e.g.YT620) for antibody/protein - 可根据所结合分子的类型或实验需要,适当调整缓冲液的盐浓度及pH。
- 2×Binding & Washing Buffer I用于洗涤时须用等体积超纯水稀释至1×。
- 可根据所结合分子的类型或实验需要,适当调整缓冲液的盐浓度及pH。
- 链霉亲和素琼脂糖凝胶准备
- 取琼脂糖凝胶并去除上清。轻轻重悬链霉亲和素琼脂糖凝胶,尽量形成均匀的凝胶悬浊液,取20~100μL置于1.5mL离心管(货号:YTB8001)中待用。
- 使用大孔径吸头(如用剪刀剪去部分吸头)吸取凝胶悬浊液会比较方便。
- 洗涤琼脂糖凝胶。加入1×TBS(货号:YTB1280、YTB1282)至最终体积为约0.5mL,轻轻重悬链霉亲和素琼脂糖凝胶。600×g在4℃离心5分钟,小心去除上清,不要吸到凝胶,完成一次洗涤步骤。然后再按照前述洗涤步骤,洗涤2次。最终去除上清,并根据后续的实验目的,用适量的适当溶液(参考步骤3a或4a)重悬链霉亲和素琼脂糖凝胶。
- 本琼脂糖凝胶及溶液并非RNase-free处理,如果用于RNA相关的应用,在上述洗涤后,用0.5mL DEPC处理过的0.05M NaCl洗涤琼脂糖凝胶2次,每次2分钟;然后再用0.5mL DEPC处理过的0.1M NaCl洗涤一次。根据后续的实验目的,按照初始体积的量,用适当溶液(参考步骤3a或4a)重悬链霉亲和素琼脂糖凝胶。
- 通常,每个样品的琼脂糖凝胶用量约为20~100μL。具体可根据生物素标记分子的多少,参考产品主要指标表中琼脂糖凝胶的“Binding capacity”,计算生物素标记分子的加入量。根据不同的实验目的,例如可以考虑生物素标记分子的加入量为琼脂糖凝胶载量的1~2倍,使琼脂糖凝胶饱和,即把琼脂糖凝胶充分利用,此时通常实验目的是分离纯化;再例如加入琼脂糖凝胶的载量是待分离纯化的生物素标记分子的2~3倍,以确保生物素标记分子能被充分分离纯化,此时通常实验目的是为了对样品中的生物素标记分子进行定量分析。
- 多个样品时,可以取总琼脂糖凝胶量合并洗涤处理后再平分到各个样品管中,洗涤液用量须相应增加。
- 也可参考相关方法进行填柱并使用重力柱法或FPLC法进行纯化。
- 通常,每个样品的琼脂糖凝胶用量约为20~100μL。具体可根据生物素标记分子的多少,参考产品主要指标表中琼脂糖凝胶的“Binding capacity”,计算生物素标记分子的加入量。根据不同的实验目的,例如可以考虑生物素标记分子的加入量为琼脂糖凝胶载量的1~2倍,使琼脂糖凝胶饱和,即把琼脂糖凝胶充分利用,此时通常实验目的是分离纯化;再例如加入琼脂糖凝胶的载量是待分离纯化的生物素标记分子的2~3倍,以确保生物素标记分子能被充分分离纯化,此时通常实验目的是为了对样品中的生物素标记分子进行定量分析。
- 取琼脂糖凝胶并去除上清。轻轻重悬链霉亲和素琼脂糖凝胶,尽量形成均匀的凝胶悬浊液,取20~100μL置于1.5mL离心管(货号:YTB8001)中待用。
- 生物素标记核酸的结合和洗脱
- 琼脂糖凝胶重悬:接步骤2b或2c,用2倍原始琼脂糖凝胶体积的2×Binding & Washing Buffer I重悬琼脂糖凝胶。
- 核酸吸附:加入等体积的用超纯水配制的生物素标记核酸样品(加入样品后体积为原始琼脂糖凝胶体积的4倍),充分振荡混悬,置于旋转混合仪上,室温孵育10~30分钟或4℃孵育2小时。
- 可通过测定反应前后核酸的浓度,计算结合到琼脂糖凝胶上的核酸量。
- 洗涤:取1mL 1×Binding & Washing Buffer I加入琼脂糖凝胶中,轻轻重悬琼脂糖凝胶,600×g在4℃离心5分钟,去除上清,不要吸到凝胶。再重复洗涤1~2次。
- 洗脱:加入100μL或适量的DNA/RNA Elution Buffer,65℃孵育5分钟或90℃孵育2分钟。
- 琼脂糖凝胶重悬:接步骤2b或2c,用2倍原始琼脂糖凝胶体积的2×Binding & Washing Buffer I重悬琼脂糖凝胶。
- 生物素标记抗体或蛋白的结合和洗脱
- 抗体或蛋白吸附:加入适量用1×Washing Buffer II稀释的生物素标记抗体、蛋白、抗原抗体复合物或蛋白复合物,轻轻重悬琼脂糖凝胶,置于旋转混合仪上,室温孵育30~60分钟或4℃孵育4~16小时。
- 洗涤:取1mL的1×Washing Buffer II加入琼脂糖凝胶,轻轻重悬琼脂糖凝胶,600×g在4℃离心5分钟,去除上清,不要吸到凝胶。重复洗涤3~4次。
- 洗脱:根据目的核酸或蛋白的特点及后续实验要求,可以选择如下方法之一或其它合适方法进行洗脱。
- 酸性洗脱缓冲液洗脱:每个样品加入100μL或适量Acid Elution Buffer (0.1M Glycine,pH2.8),混匀后置于旋转混合仪上,室温孵育5分钟,置于离心机中600×g在4℃离心5分钟,将上清转移到新的离心管中,立即加入10μL中和液(1M Tris-HCl,pH8.5),适当混匀。洗脱液置于4℃待用,或者-20℃长期保存。
- 如果选择酸性洗脱缓冲液进行洗脱,就有可能发生链霉亲和素脱落,需注意孵育时间不要超过10分钟。
- 酸性洗脱缓冲液能破坏绝大部分的抗体与抗原的相互作用。但为了确保更好的洗脱效果,可预先用300μL 0.1% Tween-20的水溶液洗涤琼脂糖凝胶1次。如果对洗脱效率的要求比较高,可用酸性洗脱液(8M Guanidine·HCl,pH1.5)进行洗脱,相应的中和液的pH值或量也要进行一定的调整,例如100μL酸性洗脱液(8M Guanidine·HCl,pH1.5)和15μL中和液(1M Tris-HCl,pH9.5)。
- 如果选择酸性洗脱缓冲液进行洗脱,就有可能发生链霉亲和素脱落,需注意孵育时间不要超过10分钟。
- SDS-PAGE Loading Buffer或0.1% SDS洗脱:每个样品加入100μL或适量的1×SDS-PAGE Loading Buffer或0.1% SDS,95℃加热3分钟。置于离心机中600×g在4℃离心5分钟,取上清用于SDS-PAGE电泳或Western检测等。
- 如果选择SDS-PAGE Loading Buffer或0.1% SDS进行洗脱,那么洗脱液将包含链霉亲和素单体和二聚体、生物素标记抗体或蛋白。
- 酸性洗脱缓冲液洗脱:每个样品加入100μL或适量Acid Elution Buffer (0.1M Glycine,pH2.8),混匀后置于旋转混合仪上,室温孵育5分钟,置于离心机中600×g在4℃离心5分钟,将上清转移到新的离心管中,立即加入10μL中和液(1M Tris-HCl,pH8.5),适当混匀。洗脱液置于4℃待用,或者-20℃长期保存。
- 抗体或蛋白吸附:加入适量用1×Washing Buffer II稀释的生物素标记抗体、蛋白、抗原抗体复合物或蛋白复合物,轻轻重悬琼脂糖凝胶,置于旋转混合仪上,室温孵育30~60分钟或4℃孵育4~16小时。
相关搜索:链霉亲和素琼脂糖凝胶,Streptavidin,链霉亲和素,Agarose,琼脂糖凝胶,Streptavidin Agarose



