产品货号:
RFT367
中文名称:
25bp DNA Ladder(25~500bp)
英文名称:
25bp DNA Marker(25-500bp)
产品规格:
50T
发货周期:
1~3天
产品价格:
询价
本制品是由8条带状双链DNA条带组成的精准定量Marker,适用于聚丙烯酰胺凝胶电泳中DNA条带大小和含量的分析。本DNA Ladder的8条带的大小分别为25、50、100、150、200、300、400、500bp。其中200bp条带为加亮带,含量为100ng/5μL,其余条带浓度为50ng/5μL。

本DNA Ladder适用于非变性的PAGE电泳和琼脂糖凝胶电泳,不适用于尿素PAGE电泳。由于片段较小,如使用琼脂糖分离,建议使用高分辨率琼脂糖凝胶电泳分离。

| 组分 | 规格 |
| 25bp DNA Ladder(25~500bp) | 250μL |
| 6×Native-PAGE DNA上样缓冲液 | 1mL |
| 6×DualColor DNA loading buffer | 1mL |
保存:2~8℃,有效期6个月;-20℃可保存3年。

一、TBE-PAGE凝胶分离
- 制备凝胶
- 参照凝胶模具说明书,装配好凝胶模具。
- 按照表一将不同体积的成分在小烧杯或试管中混合;最后加入10%APS和TEMED,轻轻搅拌使其混匀,避免产生气泡。
- 25bp DNA ladder适用于配制15%TBE-PAGE胶。
- 在凝胶模具中灌入适量分离胶溶液(对于mini-gel,凝胶液加至约距前玻璃板顶端1.5cm或距梳齿约0.5cm即可),然后在分离胶溶液上轻轻覆盖一层1-2cm的无水乙醇,使凝胶表面保持平整。
- 静置10~20分钟,待分离胶和乙醇层之间出现一个清晰的界面后,说明凝胶已聚合
表一:TBE-PAGE分离胶配方表(总体积5mL,适用于1mm厚度小板胶)最佳DNA分离范围 凝胶浓度 各成分用量(mL) 灭菌水 30% PAA(29:1) 5×TBE 10% APS TEMED 70~450bp 6% 3 1.0 1.0 0.05 0.005 60~460bp 8% 2.66 1.34 50~300bp 10% 2.33 1.67 40~200bp 12% 2 2.0 25~150bp 15% 0.5 2.5 5~100bp 20% 0.66 3.34 - 去除覆盖在分离胶上的乙醇;按照表二将不同体积成分在一个小烧杯或试管中混合;最后加入10%过硫酸铵和TEMED,轻轻搅拌使其混匀,避免产生气泡。
表二:TBE-PAGE 4%浓缩配方表(总体积1.5mL,适用于1mm厚度小板胶)凝胶浓度 灭菌水 30% PAA(29:1) 5×TBE 10%APS TEMED 4% 1mL 200μL 300μL 20μL 2μL - 将浓缩胶溶液加至分离胶的上面,直至凝胶溶液到达前玻璃板的顶端;将梳子插入凝胶内,避免产生气泡。
- 静置30~60分钟,等待浓缩胶聚合。
- 凝胶的聚合时间与环境温度有关。夏天温度较高时,聚合较快;冬天气温低时,聚合时间会延长。可以根据环境温度的不同调节APS的加入量。
- 参照凝胶模具说明书,装配好凝胶模具。
- 电泳
- 将凝胶板固定在电泳装置上,往上槽和下槽中加入1×TBE电泳液,1mL吸头冲洗加样孔1~2次。
- 取待测样品,加入相应体积6×Native PAGE DNA上样缓冲液,如5μL样品加1μL上样缓冲液,短暂离心后取5~10μL上样。25bp DNA ladder已经含有上样缓冲液,1mm厚10齿梳子直接上样5μL,其余梳齿和厚度凝胶适量调整上样量。
- 连接电源线,打开电源开关。200V稳压电泳。至二甲苯菁指示前沿到达距离凝胶下沿二分之一位置时结束电泳(~50bp),此时溴酚蓝指示前沿在凝胶下沿边界(~17bp)。
PAGE凝胶浓度 恒电压 起始电流 结束电流 二甲苯菁 溴酚蓝 电泳时间 15% 200V 25~30 mA/板胶 10~18 mA/板胶 ~50bp ~17bp 35+min
- 将凝胶板固定在电泳装置上,往上槽和下槽中加入1×TBE电泳液,1mL吸头冲洗加样孔1~2次。
- 染色
- 漂洗:玻璃板上拆下凝胶后,适量蒸馏水漂洗3~5分钟。
- 染色液配制:
TBE-PAGE胶可以使用RealGood类染料后染染色,以下程序用RealGood Red红色核酸染料(货号:RFT232)进行染色。即用型染色液配制:成分 用量 1×TBE 100mL RealGood Red核酸染料 10μL - 染色和观察:
凝胶浸泡于即用型染色液中,常温避光摇床40~60rpm染色30分钟。紫外光或蓝光仪下观察。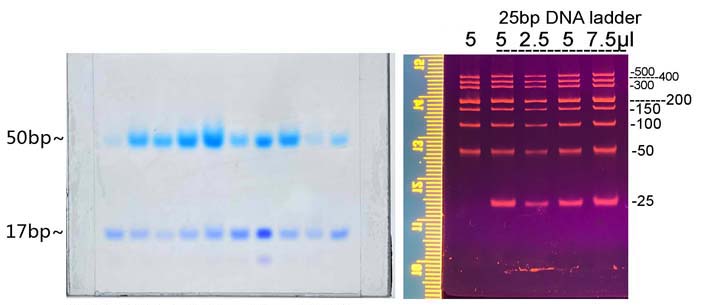
凝胶:15% T3.3C TBE-PAGE
电泳条件:1×TBE 200V 35min电流变化:28~16mA
染色:RealGood Red后染
- 漂洗:玻璃板上拆下凝胶后,适量蒸馏水漂洗3~5分钟。
二、琼脂糖凝胶分离
- 琼脂糖凝胶制备
由于片段较小,建议选用高分辨率琼脂糖制胶。以下步骤以制备50mL 3%凝胶为例:
称取1.5g琼脂糖于玻璃三角瓶中,加入50mL 1×TAE,5μL RealGood Red核酸染料或其他核酸染料(如EB,GoldView),混匀,盖好瓶盖,微波炉中火加热至沸腾,轻摇混匀,重复1~2次至琼脂糖完全溶解,无可见颗粒。倒入制胶容器中,插好梳子,常温凝固30~50分钟至凝胶完全凝固。 - 电泳
- 取待测样品,加入相应体积6×DualColor DNA loading buffer,如10μL样品加2μL上样缓冲液,短暂离心后取5~10μL上样。25bp DNA ladder 1mm厚10齿梳子上样5μL,其余梳齿和厚度凝胶适量调整上样量。
- 建议电泳条件:凝胶浓度为3%,电泳电压8-10V/cm(单位电压指电泳槽阴阳极之间的距离电压,如阴极阳极之间的距离为20cm,可以用160~200 V电压进行稳压电泳),待溴酚蓝指示前沿距离凝胶末端2cm时终止电泳,电泳时间35~40分钟。
琼脂糖浓度 电泳缓冲液 二甲苯菁 溴酚蓝 单位电压 电泳时间 3% 1×TAE ~1000bp ~100bp 8~10V/cm 40min+ 1×TBE ~700bp ~60bp 8~10V/cm 40min+
- 取待测样品,加入相应体积6×DualColor DNA loading buffer,如10μL样品加2μL上样缓冲液,短暂离心后取5~10μL上样。25bp DNA ladder 1mm厚10齿梳子上样5μL,其余梳齿和厚度凝胶适量调整上样量。
- 观察条带
使用EB或Goldview染料时,由于染料本身带正电荷较多,随着电泳时间的延长,染料会向阴极聚集,导致小片段核酸结合的染料含量降低,会出现小片段的DNA片段紫外灯下亮度变弱或不可见。此时可以将胶浸泡于含有染料的电泳缓冲液中染色15~20分钟即可看到小片段。使用RealGood类染料可以直接观察条带。 - 实验示例
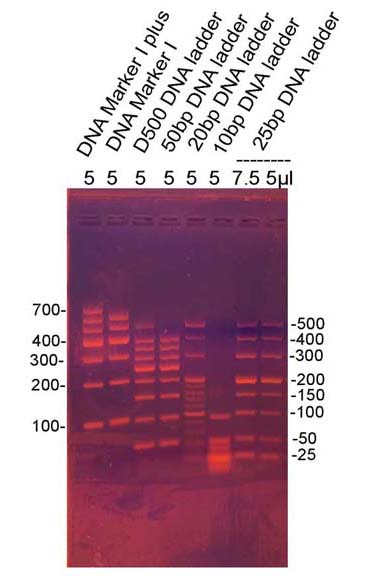
3%琼脂糖凝胶
电泳条件:1×TAE 150V 45min
染色:RealGood Red后染
相关搜索:25bp DNA Ladder(25~500bp),DNA Ladder,DNA Marker,DNA分子量标准,双链DNA,dsDNA,非变性电泳,PAGE电泳,琼脂糖凝胶电泳,聚丙烯酰胺凝胶电泳,Native-PAGE,25bp DNA Marker(25-500bp)



