产品货号:
YTB4093
中文名称:
高保真血液直扩PCR Mix
英文名称:
2×LoadEasy HF Blood Direct PCR Mix
产品规格:
20μL×100T|20μL×500T
发货周期:
1~3天
产品价格:
询价
本制品是一种使用特别便捷的专门用于血液样品2倍浓度的高保真PCR预混液,并且PCR结束后可以直接上样电泳无需添加上样缓冲液。本制品含有耐血的BloodTaq高保真DNA聚合酶,这是一种经过基因工程改造的非常高效的并且具有高保真性的适用于EDTA、肝素或柠檬酸钠抗凝血样品或干血斑样品直接PCR检测的耐热DNA聚合酶。
本制品中含有的BloodTaq HF DNA聚合酶的保真性高于Pfu DNA聚合酶,和更高保真性的BalbFusion DNA聚合酶的保真性相近。因此本制品不仅可以用于血液检测目的,也可以用于PCR扩增并克隆特定基因。
本制品提供了一对阳性对照引物,便于确认PCR检测效果。该对引物是一种哺乳动物的通用引物,可以扩增SOX21基因上游非编码区约237bp DNA片段,也可用于大多数脊椎动物。

本制品可用于抗凝血样品基因组DNA中目的基因的直接扩增、基因分型(如基因缺失等)、血液样品中细菌、病毒等微生物感染的基因检测,以及基因敲除或转基因小鼠基因型分析。

- 对于全血样品可以直接PCR检测,无须提取DNA。
本制品对人、小鼠等全血中血红素等各种PCR抑制剂表现出超强的抗性,对于新鲜采集的、4℃保存或低温冻存EDTA、肝素或柠檬酸钠抗凝的人或小鼠血液样品或者干血斑(如whatman903或FTA采血卡上的干血斑),都无需进行DNA提取纯化,可以直接用于PCR扩增目的DNA。 - 所需血样少,耐血能力高。
本制品用于20μL的PCR扩增体系时,通常仅加入约1μL抗凝全血即可顺利完成PCR检测。用于检测细菌、病毒等微生物感染时,为获得最高的检测灵敏度,20μL的PCR扩增体系中最大加入的血液量可以达到4μL,即20%体积,有些类型的抗凝血(例如人肝素抗凝血)最大加入的全血体积可以达到10μL,即50%体积。 - 兼容EDTA、肝素或柠檬酸钠三种常见抗凝血。
血液样品用于PCR检测时,EDTA、肝素或柠檬酸钠抗凝血都可以兼容的。如果希望取得最佳的检测效果,优先推荐EDTA抗凝血。因为EDTA可以螯合多种核酸酶发挥酶活性所必须的金属离子,从而可以更好地抑制核酸的降解。 - 本制品的耐血体积百分比可以达到20~50%。
- 本制品可以轻松扩增5kb或更长的目的片段。

本制品用于肝素、柠檬酸钠和EDTA抗凝血PCR检测的效果参考图1。图中可见,本制品对肝素(heparin)、柠檬酸钠和EDTA处理的人全血的耐受体积百分比可以达到50%、20%和40%。对于小鼠全血的PCR检测,本制品可以耐受的体积百分比也不小于20%。综上,本制品用于PCR检测时,推荐的全血的使用量为PCR总体积的1~20%,最优先的推荐用量为5~10%。
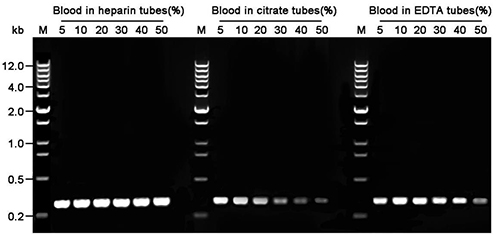
图1.使用2×LoadEasy HF Blood Direct PCR Mix扩增图中所示不同抗凝剂采集的人抗凝全血中目的基因的检测效果图。使用2×LoadEasy HF Blood Direct PCR MasterMix及本制品提供的Control primer mix,在PCR体系中直接加入不同体积百分比的不同抗凝剂采集的人抗凝血,用于扩增β-actin基因的300bp DNA片段后的电泳效果图。M,DNA marker (0.2~12kb,12 bands)。
本制品扩增不同长度目的基因的效果参考图2。图中可见,2×LoadEasy HF Blood Direct PCR MasterMix以柠檬酸钠抗凝全血为模板可以直接PCR扩增出5kb或更长的DNA片段。
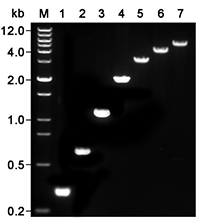
图2.使用2×LoadEasy HF Blood Direct PCR Mix直接以10%柠檬酸钠抗凝全血为模板扩增不同长度的目的基因的效果图。M,DNA marker (0.2~12kb,12 bands);1,β-actin (300bp);2,CCR5 (630bp);3,CCR5 (1100bp);4,CCR5 (2000bp);5,IL-6 (2841bp);6,IL-6 (4171bp);7,IL-6 (4882bp)。

扩增产物不能直接用于TA克隆,本制品扩增获得的PCR产物为平末端,不能直接用于和T载体连接进行TA克隆。

酚氯仿抽提可以使2×LoadEasy HF Blood Direct PCR MasterMix中含有的BloodTaq HF DNA Polymerase失活。

| 组分 | 20μL×100T | 20μL×500T |
| 2×LoadEasy HF Blood Direct PCR MasterMix | 1mL | 5×1mL |
| Control primer mix (10μM each) | 25μL | 125μL |
保存:-20℃,避免反复冻融。

- 由于PCR反应非常灵敏,在使用2×LoadEasy HF Blood Direct PCR MasterMix时请注意避免微量待扩增DNA的污染,并尽量考虑设置不加模板的空白对照以确认是否有待扩增DNA的污染。
- 设置PCR反应体系时,抗凝血的推荐用量为PCR体系总体积的5%左右,可以直接添加到PCR体系中,无需进行任何额外处理。
- PCR反应结束之后,建议3000~5000g离心3~5min以沉淀血细胞碎片,便于吸取上清用于电泳分析等。
注意:由于抗凝血本身的原因,PCR结束后在PCR管底部会出现透明凝胶状物质,此为正常现象。 - 需自备Nuclease-Free Water。推荐选购百奥莱博的BalbPure Ultrapure Water (DNase/RNase-Free,Sterile,货号:YT998)。

- PCR反应体系的设置:
- 融解并混匀2×LoadEasy HF Blood Direct PCR MasterMix和Control primer mix (10μM each),置于冰浴上或冰盒内。
- 参考下表在冰浴上设置PCR反应体系:
成分 20μL体系 50μL体系 终浓度 Nuclease-Free Water (9-x)μL (22.5-y)μl - 2×LoadEasy HF Blood Direct PCR MasterMix 10μL 25μL 1X 引物混合物(10μM each) 1μL 2.5μL 0.5μM each 抗凝全血 xμl yμl - 总体积 20μL 50μL -
注意:
① 模板使用量:
作为PCR模板的抗凝血用量一般为PCR反应体系总体积的1~20%,建议起始使用量为5%。如果PCR反应用于检测基因组的DNA片段,可以适当减少抗凝血用量;如果用于检测血液样品中某种病毒或细菌等微生物的目的DNA片段,建议使用50μL的PCR体系,并使用较大的模板血量。对于高GC含量的PCR扩增,可以尝试向PCR体系中加入终浓度1~10% (体积百分比)的DMSO。对于干血斑样品,20μL和50μL的PCR体系中分别推荐使用约0.8平方毫米和2平方毫米的干血斑。
② 引物浓度:
通常引物的终浓度为0.5μM时可获得良好的检测效果,也可以根据情况在0.1~1.0μM范围内调整引物的终浓度。扩增效率不高的情况下,可提高引物的浓度;发生非特异性反应时,可降低引物浓度。 - 用移液器轻轻吹打混匀或轻微Vortex混匀,室温离心数秒,使液体积聚于管底。
- 如果所使用的PCR仪有热盖则省略本步骤。如果PCR仪没有热盖,则在管内滴入一滴矿物油(货号:YT399)。
- 把设置好的PCR反应体系置于PCR仪上,开始PCR反应。
- 融解并混匀2×LoadEasy HF Blood Direct PCR MasterMix和Control primer mix (10μM each),置于冰浴上或冰盒内。
- PCR反应参数的设置可以参考如下表格:
PCR步骤 扩增片段小于1kb时 扩增片段大于1kb时 STEP1 (起始变性) 94℃ 5min 94℃ 5min STEP2 (变性) 94℃ 30sec 94℃ 30sec STEP3 (退火) 55℃ 30sec 55℃ 30sec STEP4 (延伸) 68℃ 15sec/kb 68℃ 1min/kb STEP5 (循环) Go To STEP2 for 30-40 cycles Go To STEP2 for 30-40 cycles STEP6 (最终延伸) 68℃ 10min 68℃ 15min STEP7 (临时保存) 4℃ forever 4℃ forever
注意:
① 起始变性(94℃,5min)可以使白细胞裂解,释放出可用于PCR扩增的基因组DNA。
② 需根据每次反应的模板、引物、PCR产物的长度和GC含量等适当优化PCR反应条件,包括温度、时间和循环数等。
③ 对于初次进行的PCR,为尽量确保可以扩增出预期的PCR产物,可以把循环数设置为35。用于目的基因扩增和考虑,循环数通常为30~35,如果用于微量微生物感染的检测,循环数可以尝试设置为35~40。

- PCR产物非常少或没有特异性条带。
- 引物设计不佳是PCR过程中最常见的问题。请选择适当的引物设计软件进行引物设计,注意引物的GC含量、二级结构、二聚体、退火温度、长度、特异性等方面的问题。在加入酶切位点等的引物中,一定要注意加入酶切位点等后整条引物的GC含量、二级结构、二聚体、退火温度、长度、特异性等方面的问题。在原有引物效果不佳的情况并且阳性对照引物可以正常工作的情况下,可以考虑更换引物。
- 待扩增片段GC含量偏高。向PCR体系中加入适合扩增高GC含量DNA片段的试剂,并相应地根据其要求或说明调整PCR反应参数的设置。
- 目的片段过长。尽管BloodTaq HF DNA Polymerase可以扩增最长达5kb的DNA片段,但大多数时候更适合扩增2~3kb以下的片段。对于过长的目的片段的扩增,需要适当优化引物和PCR反应参数。
- 引物的二级结构、引物二聚体或引物偏短会导致退火效果不佳。此时可以采用Touch down等方法进行退火,通常采用从65℃逐步缓慢降温到55℃或50℃的方法,使退火更加充分。
- 退火温度不佳,需要优化。如果有温度梯度PCR仪,则可以设置退火的温度梯度,摸索退火的最佳温度。如果没有温度梯度PCR仪,则可以通过多次PCR反应摸索最佳的退火温度。
- 延伸时间不足。可按照每1kb片段延伸15秒进行设置,对于较难扩增的片段可以设置为每1kb片段延伸30~60秒。
- 在不同PCR仪上进行PCR反应,避免有时PCR仪出现问题。
- 循环数不足,适当延长PCR的循环数。通常循环数最高不必超过40,常用的循环数范围为30~40。
- 模板用量偏少,可以在耐血体积范围内适当加大样品用量,或采用巢式PCR (nested PCR)或二次PCR。巢式PCR即为在原先设计的PCR引物内侧再设计一对PCR引物,然后对第一次PCR产物进行稀释后再进行一次PCR扩增,这样一方面可以起到扩增作用,同时也可以从第一次PCR产物中扩增出特异性条带。二次PCR则为比较简单地用原有引物对第一次PCR产物进行稀释后再进行一次PCR扩增,可以起到扩增作用,但不能去除非特异性条带。
- 对PCR引物进行脱盐甚至PAGE胶或HPLC纯化。
- 当产生较多非特异性条带时,可以适当提高退火温度。
- 注意设置适当的阳性对照和阴性对照通常会对于实验结果的判断有很大帮助。
- 引物设计不佳是PCR过程中最常见的问题。请选择适当的引物设计软件进行引物设计,注意引物的GC含量、二级结构、二聚体、退火温度、长度、特异性等方面的问题。在加入酶切位点等的引物中,一定要注意加入酶切位点等后整条引物的GC含量、二级结构、二聚体、退火温度、长度、特异性等方面的问题。在原有引物效果不佳的情况并且阳性对照引物可以正常工作的情况下,可以考虑更换引物。
- 杂带较多或条带弥散
- 退火温度提高2~5℃。
- 减少抗凝全血的用量。
- 在室温配制PCR体系容易产生非特异性条带。推荐在冰浴上配制PCR反应体系。
- 如果模板的GC含量过高,需要考虑加入适合扩增高GC含量DNA片段的试剂。
- 适当缩短延伸时间。
- 退火温度提高2~5℃。
相关搜索:高保真血液直扩PCR Mix,血液样本,抗凝血样本,全血样本,干血斑样本,直接扩增,直接PCR,PCR Mix,基因分型,高保真扩增,高保真PCR,免DNA提取,无需提取DNA,2×LoadEasy HF Blood Direct PCR Mix



