产品货号:
YTB4318
中文名称:
抗GFP抗体磁珠
英文名称:
BalbMag Anti-GFP Magnetic Beads
产品规格:
500μL|2mL
发货周期:
1~3天
产品价格:
询价
本制品是由高品质的GFP小鼠单克隆抗体与纳米级氨基磁珠共价偶联而成,可特异性地与动植物或微生物裂解液、血清、腹水等中含有GFP标签的蛋白结合,从而用于带有GFP标签的融合蛋白或其蛋白复合物的免疫沉淀(IP)、免疫共沉淀(Co-IP)或纯化。
BalbMag Anti-GFP Magnetic Beads可以特异性地结合GFP或EGFP等标签融合蛋白,并可以借助磁力架等磁分离设备非常便捷地应用于带有GFP标签的融合蛋白或其蛋白复合物的免疫沉淀或纯化等实验。

| 组分 | 500μL | 2mL |
| BalbMag Anti-GFP Magnetic Beads | 500μL | 2mL |
| 说明书 | 1份 | 1份 |
保存:4℃保存,两年有效。长期不使用可置于-20℃保存。

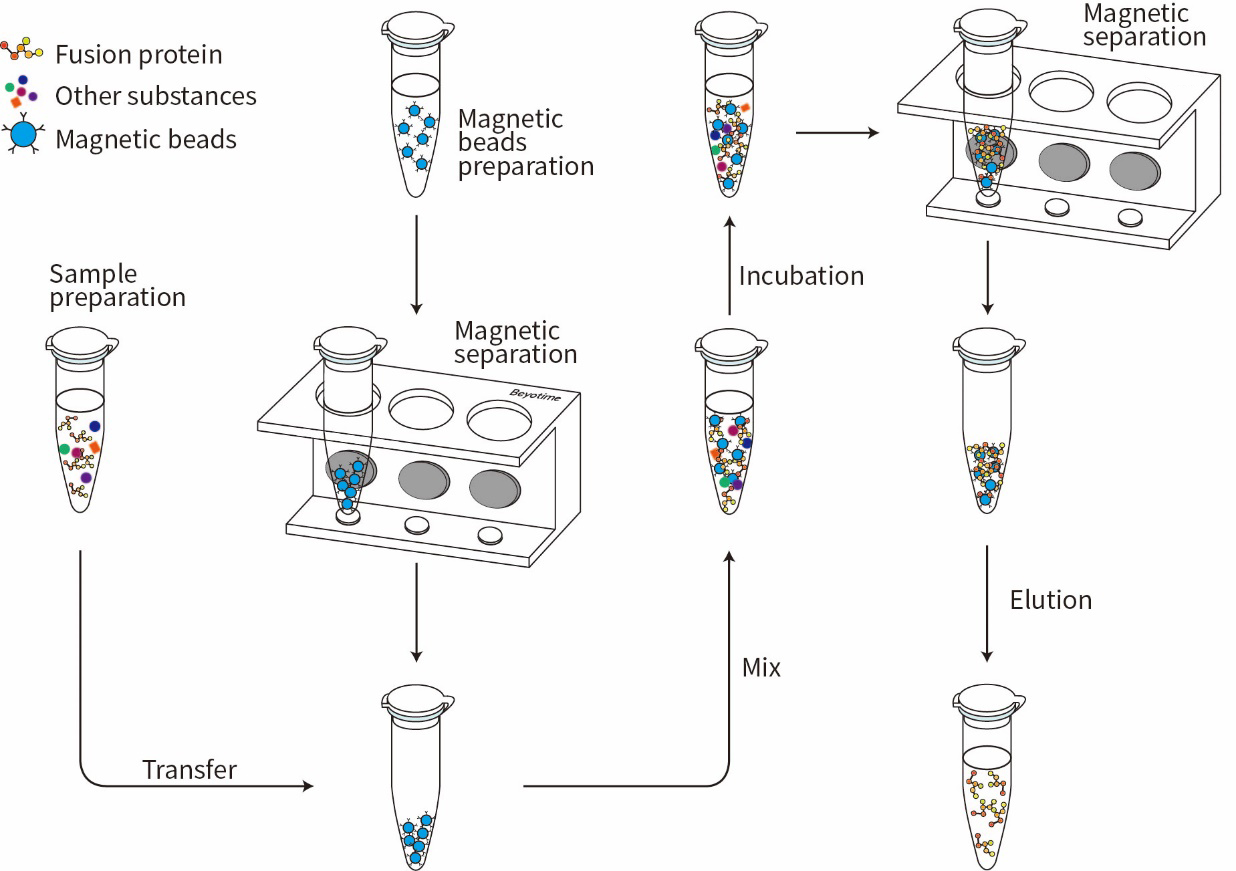
图1.BalbMag Anti-GFP Magnetic Beads免疫沉淀流程图。

本制品用于GFP-融合蛋白的免疫沉淀效果参考图2。
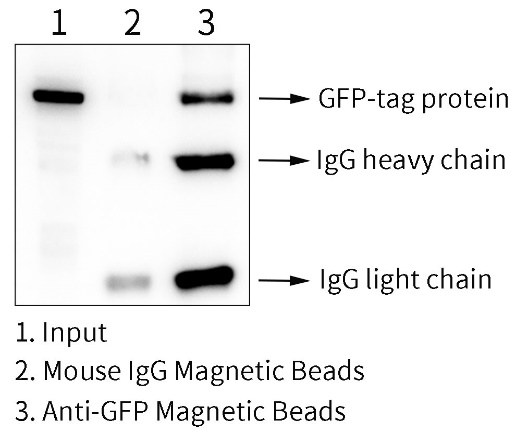
图2.BalbMag Anti-GFP Magnetic Beads用于GFP-融合蛋白的免疫沉淀效果图。293T (人胚肾细胞)转染含GFP-tag质粒36小时后,经Western及IP细胞裂解液裂解。样品1为Input,即全细胞裂解液(total);样品2为小鼠IgG免疫磁珠免疫沉淀后经SDS-PAGE蛋白上样缓冲液(1X洗脱后的样品,该Mouse IgG是正常的小鼠IgG,为阴性对照;样品3为本磁珠免疫沉淀后的样品,该样品使用SDS-PAGE蛋白上样缓冲液(1X)洗脱。使用SDS-PAGE蛋白上样缓冲液(1X)洗脱后可以检测到GFP抗体的轻重链。实际结果会因实验条件、检测仪器等的不同而存在差异,图中数据仅供参考。

GFP(绿色荧光蛋白)最早是由下村修、钱永健等人于1962年在维多利亚多管发光水母中发现的,当受到紫外或蓝光激发时,发射绿色荧光。GFP或其突变体EGFP (增强型绿色荧光蛋白)与目的蛋白融合表达被广泛用于基团表达调控、转基因功能、目的蛋白在细胞中的表达、分布和迁移、以及高通量药物筛选等方面的研究。GFP标签的优点是便于观察,适合于观察蛋白在细胞内的定位,不用破碎组织细胞、不加任何底物、不用抗体,直接通过荧光显微镜就能在活细胞中观察到发出的绿色荧光,实时观察目的蛋白的表达情况,而且荧光性质稳定,细胞内的其它产物不会干扰GFP标签蛋白的检测,从而使其检测快速、简便、灵敏度高、重现性强,所以GFP被誉为活细胞探针。但GFP标签的分子量较大,约为25kDa,与目的基因形成融合蛋白时可能会影响目的蛋白的功能。

- 特异性强、靶蛋白结合量高:与国内外大多数的同类产品相比,本制品抗体结合密度高,对带有GFP标签蛋白的结合具有很强的特异性,并且本制品磁珠粒径小,不易产生非特异吸附。本制品每毫升 磁珠悬浊液含约10mg磁珠,含有不少于0.6mg GFP抗体,通常可结合不少于0.6mg GFP标签融合蛋白,具体的最大结合量和标签蛋白的分子量大小等相关。每500μL样品,通常仅需使用10~20μL磁珠悬浊液,就可以高效地进行免疫沉淀实验。
- 可结合多种形式的GFP标签蛋白:本制品可特异性地结合N端GFP融合蛋白(GFP-Protein)、C端GFP融合蛋白(Protein-GFP)。
- 结合目的蛋白速度快:本制品使用了纳米级磁珠(~200nm),具有超大的比表面积,便于抗体和抗原的快速有效结合。通常10分钟内即可完成抗原吸附的过程,30分钟内完成目的蛋白免疫沉淀操作。缩短操作时间可以有效避免在长时间操作过程中目的蛋白的降解或变性,充分保证目的蛋白的活性。
- 使用便捷:本制品储存在特殊保护液中,不含甘油,可以通过磁性吸附实现快速高效的分离,无需离心操作。
- 可选择多种洗脱方法:本制品可以根据目的蛋白的结构、生物学功能及后续应用的要求等,使用多种洗脱方法,包括SDS-PAGE上样缓冲液和酸性等洗脱液进行洗脱。

| 磁珠浓度 | 10mg/mL |
| 磁珠粒径 | 200nm左右 |
| 磁珠磁性 | 超顺磁性 |
| 偶联抗体 | 小鼠抗GFP单抗 |
| 抗体类型 | IgG1 |
| 抗体分子量 | 约150kDa |
| 抗体浓度 | ≥0.6mg/mL磁珠 |
| 结合能力 | ≥ 0.6mg GFP标签蛋白/mL磁珠 |
| 特异性 | GFP-Protein |
| 应用 | IP、Co-IP、蛋白纯化 |

- 本抗GFP磁珠使用的GFP抗体的抗原为GFP蛋白的N端约20个氨基酸的多肽,由于GFP标签本身的分子量较大,约25kDa,与目的基因形成融合蛋白后分子量更大,而且融合蛋白的结构复杂性可能会影响抗GFP磁珠对GFP蛋白N端的识别,建议通过预实验进行免疫沉淀的验证或对裂解条件进行一定的调整。
- 由于GFP-tag与GFP抗体的结合力非常强,酸性洗脱的效果可能比较差,建议优先使用SDS-PAGE上样缓冲液洗脱法。
- 本制品需维持pH为6~8,避免高速离心、干燥或冻存;请勿长时间将磁珠置于磁场中,否则可能会引起磁珠聚团。
- 本制品使用前要适当充分重悬,即颠倒若干次使磁珠混合均匀,混匀操作须轻柔,不宜剧烈涡旋震荡等,避免抗体变性等。
- 在免疫沉淀或纯化时,建议设置阳性和阴性对照组。
- 蛋白样品收集后宜尽快完成纯化工作,并应始终放置在4℃或冰浴,以减缓蛋白降解或变性。为有效抑制蛋白降解,可以在蛋白样品中添加适量的蛋白酶抑制剂混合物,例如通用型蛋白酶抑制剂混合物、蛋白酶磷酸酶抑制剂混合物(质谱兼容)、哺乳动物样品提取用蛋白酶抑制剂混合物、哺乳动物样品提取用蛋白酶磷酸酶抑制剂混合物等。
- 如果使用真空泵等仪器吸取上清液,须注意真空泵的吸液强度,以免吸力过大而吸取到聚集的磁珠。
- 酸性溶液洗脱时磁珠可能会发生聚集,属于正常现象,不影响磁珠的正常使用。0.1%的非离子型去垢剂(如Triton X-100、Tween-20或NP-40)可有效防止磁珠聚集,并且不会影响磁珠的抗体结合效率。
- 高浓度的DTT、巯基乙醇、盐酸胍等对本制品与标签蛋白的结合可能有一定影响,但Western及IP细胞裂解液、RIPA裂解液(YT609、YT610、YT611)或NP-40裂解液等都完全适用。

- 样品的制备
- 选择合适的裂解液,用于制备细胞或组织的裂解液。优先推荐选择Western及IP细胞裂解液用于细胞或组织样品的裂解。根据特定的实验目的,如有必要,也可以使用RIPA裂解液(强)、RIPA裂解液(中)或RIPA裂解液(弱)用于样品的制备。如果使用自行配制的或其它公司生产的裂解液,需要确保裂解液的pH为6~8。
- 本抗GFP磁珠使用的GFP抗体的抗原为GFP蛋白的N端约20个氨基酸的多肽,由于GFP标签本身的分子量较大,约25kDa,与目的基因形成融合蛋白后分子量更大,而且融合蛋白的结构复杂性可能会影响抗GFP磁珠对GFP蛋白N端的识别,建议通过预实验进行免疫沉淀的验证或对裂解条件进行一定的调整。
- 具体的细胞或组织样品裂解的制备步骤请参考裂解液的使用说明。制备好的裂解液上清宜置于冰上或4℃存放,随后即可用于免疫沉淀或免疫共沉淀、标签蛋白的纯化等操作。新鲜制备好的样品,建议尽量当天完成免疫沉淀等后续操作,但如果样品不能当天使用,也可以适当分装后-80℃冻存。
- 选择合适的裂解液,用于制备细胞或组织的裂解液。优先推荐选择Western及IP细胞裂解液用于细胞或组织样品的裂解。根据特定的实验目的,如有必要,也可以使用RIPA裂解液(强)、RIPA裂解液(中)或RIPA裂解液(弱)用于样品的制备。如果使用自行配制的或其它公司生产的裂解液,需要确保裂解液的pH为6~8。
- 抗GFP磁珠的准备
由于抗GFP磁珠储存在特殊保护液中,所以需要在加入样品前适当洗涤。- 用移液器轻轻吹打重悬抗GFP磁珠,按照每500μL样品10μL或20μL磁珠悬浊液,取适量抗GFP磁珠至一洁净离心管中,加入1×TBS (YTB1282、YTB1280)至最终体积为约0.5mL。
- 如果初始体积大于0.2mL,可以考虑先直接置于磁力架上分离10秒,去除上清,然后再加入1×TBS至最终体积为约0.5mL。
- 用移液器轻轻吹打重悬抗GFP磁珠。置于磁力架上分离10秒,去除上清。重复上述步骤两次。
- 按照初始体积的量,用1×TBS重悬抗GFP磁珠。
- 用移液器轻轻吹打重悬抗GFP磁珠,按照每500μL样品10μL或20μL磁珠悬浊液,取适量抗GFP磁珠至一洁净离心管中,加入1×TBS (YTB1282、YTB1280)至最终体积为约0.5mL。
- 免疫沉淀(IP)
- 加入磁珠与孵育
按照每500μL蛋白样品加入10μL或20μL磁珠悬浊液的比例加入抗GFP磁珠,置于侧摆摇床或旋转混合仪上,室温孵育2小时或4℃孵育过夜。- 孵育过程中,如果磁珠发生聚团或呈片状属正常现象,不会影响实验结果。
- 磁分离
孵育完毕后,置于磁力架上分离10秒,去除上清。- 可保留部分上清液,用于检测免疫沉淀的效果。
- 洗涤
加入500μL的1×TBS,用移液器轻轻吹打重悬抗GFP磁珠。置于磁力架上分离10秒,去除上清。重复洗涤三次。- 也可以通过检测洗涤得到的洗涤液的OD280来判断是否洗涤完全,若OD280大于0.05,应适当增加洗涤次数。
- 加入磁珠与孵育
- 洗脱
根据标签蛋白的特点及后续实验要求,可以选择如下2种方法之一进行洗脱。- SDS-PAGE上样缓冲液洗脱法:本方法为变性法,得到的蛋白样品适合SDS-PAGE电泳或WB检测。
① SDS-PAGE上样缓冲液的配制:可以直接使用SDS-PAGE蛋白上样缓冲液(1X),或使用SDS-PAGE蛋白上样缓冲液(5X)或自行参考《分子克隆》等配制5X或2×的SDS-PAGE蛋白上样缓冲液,然后加入水配制成1×的SDS-PAGE蛋白上样缓冲液。通常SDS-PAGE蛋白上样缓冲液含有DTT等还原剂,其洗脱得到的蛋白样品中会含有GFP抗体的轻链和重链。
② 每10~20μL原始磁珠体积的磁珠,加入100μL 1×SDS-PAGE上样缓冲液,95℃加热5分钟。
③ 置于磁力架上分离10秒,取上清进行SDS-PAGE电泳或Western检测。 - 酸性洗脱法:本方法为非变性法,洗脱后的蛋白保持原有的生物活性,便于后续分析检测。
① 溶液的配制:酸性洗脱液(0.1M Glycine-HCl,pH3.0),中和液(0.5M Tris-HCl,pH7.4,1.5M NaCl)。
② 每10~20μL原始磁珠体积,加入100μL酸性洗脱液,混匀后置于侧摆摇床或旋转混合仪上,室温孵育5分钟。- 孵育时间不宜超过15分钟。
- 洗脱液的体积可以酌情适当调整,同时须注意后续的中和液体积也需要作相应调整。
③ 孵育完毕后,置于磁力架上分离10秒,将上清转移到新的离心管中,并加入10μL中和液,适当混匀。
④ 为了获得最大的洗脱效率,可重复步骤②和③,并将相同样品合并。
⑤ 洗脱并中和的GFP标签蛋白置于4℃待用,或者-20℃或-80℃长期保存。- 由于GFP-tag与GFP抗体的结合力非常强,酸性洗脱的效果可能比较差,建议优先使用SDS-PAGE上样缓冲液洗脱法。
- 由于目的蛋白的差异可能对酸性洗脱法的洗脱效率有一定的影响,如果对洗脱效率的要求比较高,可对酸性洗脱液的pH在2.5~3.1之间进行一定的调整,相应的中和液的pH值或量也要进行一定的调整,例如100μL酸性洗脱液(0.1M Glycine-HCl,pH2.8)和15μL中和液(1M Tris-HCl,pH8.5)。
- SDS-PAGE上样缓冲液洗脱法:本方法为变性法,得到的蛋白样品适合SDS-PAGE电泳或WB检测。

| 问题 | 可能原因 | 解决方案 |
| 洗脱液中GFP标签蛋白极少或无 | 蛋白未完全洗脱 | 更换洗脱方法。 |
| 目的蛋白未表达 | 通过Western blot或斑点印迹法检测,确保目的蛋白带有GFP标签。 | |
| 蛋白质表达水平极低 |
| |
| 洗涤条件过于严格 | 减少洗涤时间和洗涤次数。 | |
| 孵育时间不足 | 延长孵育时间。 | |
| 样品中存在干扰物质 | 含有高浓度DTT、2-巯基乙醇或其他还原剂的裂解液可能会破坏抗体功能,必须避免使用。 | |
| 检测系统不足 | 若使用Western blot检测:
| |
| 背景过高 | 蛋白与GFP抗体发生非特异性结合,磁珠洗涤不充分,或与离心管发生非特异性结合 |
|
| 洗涤不充分 |
| |
| 洗脱液中出现多条蛋白条带 | 蛋白质在室温下不稳定 | 在较低温度(如4℃)下纯化目的蛋白。 |
| 纯化过程中蛋白酶活性导致蛋白质降解 | 向细胞裂解液中添加蛋白酶抑制剂。 | |
| 非特异性结合 |
|
相关搜索:抗GFP抗体磁珠,抗GFP磁珠,GFP标签抗体磁珠,GFP融合蛋白磁珠,抗GFP标签抗体磁珠,抗GFP融合蛋白磁珠,Anti-GFP磁珠,GFP抗体磁珠,Anti-GFP免疫磁珠,GFP-Tag抗体磁珠,抗GFP-Tag抗体磁珠,抗GFP-Tag磁珠,BalbMag Anti-GFP Magnetic Beads



