产品货号:
YT029
中文名称:
T4 DNA连接酶
英文名称:
T4 DNA Ligase
产品规格:
40KU|200KU
发货周期:
1~3天
产品价格:
询价
T4 DNA连接酶,可以催化粘端或平端双链DNA或RNA的5'-P末端和3'-OH末端之间以磷酸二酯键结合,该催化反应需ATP作为辅助因子。同时T4 DNA连接酶可以修补双链DNA、双链RNA或DNA/RNA杂合物上的单链缺刻。

T4 DNA Ligase常用于DNA片段和载体、linker或adaptor等的连接。也可以用于缺刻修复及Ligase介导的RNA检测。

T4 DNA Ligase连接产物转化感受态后涂板LB平板的效果参考图1。
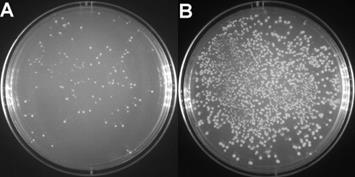
图1.本T4 DNA Ligase的连接产物转化感受态细菌后涂板获得的LB平板效果图。A.双酶切后的载体纯度:不含DNA内切酶、外切酶和磷酸酯酶,不含RNA酶,满足常规连接反应要求。

本T4 DNA Ligase由大肠杆菌表达,表达基因的来源为T4嗜菌体。

One unit is defined as the amount of enzyme required to give 50% ligation of HindIII fragments of lambda DNA in 30min at 16℃ in 20μL of the assay mixture containing 50mM Tris,pH7.5,10mM MgCl2,10mM DTT,1mM ATP,25μg/mL BSA and a 5'-DNA termini concentration of 0.12μM (300μg/mL)。
200U等于1个Weiss unit,以Weiss unit计,本制品共200Weiss unit和1000 Weiss unit。

| 组分 | 40KU | 200KU |
| T4 DNA Ligase(1KU/μL) | 40μL | 200μL |
| 10×Ligation Buffer | 300μL | 1.5mL |
保存:-20℃

20mM Tris(pH7.5),50mM KCl,1mM DTT,0.1mM EDTA and 50% (v/v) glycerol。

10×Ligation Buffer:
400mM Tris(pH7.8),100mM MgCl2,100mM DTT,10mM ATP。

- 65℃孵育10分钟可以导致T4 DNA Ligase失活;
- NaCl或KCl浓度大于200mM时强烈抑制T4 DNA Ligase。

- 对于普通的转化大肠杆菌的操作,不必对连接产物进行纯化,连接产物可以直接用于转化。但用电转方法转化大肠杆菌时,通常宜先用DNA纯化试剂盒或酚氯仿抽提方法等纯化DNA,然后再进行电转。
- 需进行平端连接或快速连接时,推荐使用百奥莱博的快速DNA连接试剂盒(货号:YT028)。T4 DNA Ligase可以进行平端连接,但效率较低。
- 普通连接反应不必进行凝胶电泳观察。如果需要对于连接产物进行凝胶电泳观察,推荐先在65℃孵育10分钟使
- T4 DNA Ligase失活,以避免T4 DNA Ligase和DNA结合导致的条带位置迁移(band shift)。
- 本制品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品。
- 为了您的安全和健康,请穿实验服并戴一次性手套操作。

- PCR产物或酶切片段和普通载体的连接:
- 取1~2μg载体酶切过夜,或至少酶切3~5小时以上。尽量确保酶切充分,否则后续会导致产生很多自连的克隆。
- 载体酶切完毕后,可以使用试剂盒进行纯化,例如百奥莱博的PCR产物DNA纯化试剂盒(货号:YT009)。也可以采用常规的酚氯仿抽提乙醇沉淀方法纯化载体。对于酶切产生较大片段(大于50~60bp)的情况推荐采用切胶回收的方式。
- 对于PCR产物:PCR产物凝胶电泳后,切胶回收预期大小的DNA片段。凝胶中DNA片段的回收可以使用试剂盒进行操作,例如百奥莱博的琼脂糖凝胶DNA回收试剂盒(货号:YT010)。也可以采用反复冻融等方法回收DNA片段。
- 对于回收的PCR产物或其它需酶切的质粒或DNA片段,用适当内切酶酶切,随后纯化酶切产物。
注:这一步的酶切不必酶切特别充分,通常酶切效率能达到80~90%以上即可。即本步骤的酶切通常酶切1~2小时即可。酶切产物可以使用试剂盒进行纯化,例如百奥莱博的PCR产物DNA纯化试剂盒(货号:YT009)。也可以采用常规的酚氯仿抽提乙醇沉淀方法纯化。 - 取约25~100ng经过酶切和纯化的载体,加入3倍摩尔数的待插入片段。参考下表设置连接反应体系。
注1:很多时候由于载体量和待插入片段的量都比较少,在回收后很难定量。此时可根据回收前电泳条带的亮度进行大致的估计。通常以DNA分子量标准的某一条带为参考,估计或通过灰度半定量您的目的条带和该参考条带的亮度的比例关系。然后再按照预计的纯化或凝胶回收时的得率计算出最终得到的载体量和待插入片段量的比例关系。
注2:通常每个反应使用0.2~0.5μL连接酶已经足够,如果希望进一步提高连接效率,可以把连接酶的用量提高至1μL。载体 约50~100ng 待插入片段 约载体摩尔数的3倍 10×Ligation Buffer 2μL 双蒸水或Milli-Q水 至20μL T4 DNA ligase 0.2~0.5μL 总体积 20μL - 用移液器轻轻吹打混匀或轻微Vortex混匀,室温离心数秒,使液体积聚于管底。
- 20~25℃孵育连接1~2小时,或16℃孵育连接过夜。
注1:对于双平端连接必须连接过夜。对于双平端连接,直接使用T4 DNA Ligase连接效率较低,推荐使用百奥莱博的快速DNA连接试剂盒(货号:YT028)。
注2:为快速获得预期克隆可以参考如下方法:对于20μL的粘端连接反应,在连接1~2小时后可以取10μL直接转化大肠杆菌,其余10μL可以16℃孵育连接过夜。如果第二天顺利获得克隆,即可进入下一步实验;如果第二天转化的大肠杆菌未获得预期的克隆,则可以取连接过夜的剩余连接产物再次转化大肠杆菌。 - 随后即可直接取连接产物用于转化感受态细菌。
- 取1~2μg载体酶切过夜,或至少酶切3~5小时以上。尽量确保酶切充分,否则后续会导致产生很多自连的克隆。
- PCR产物和T载体的连接:
- PCR产物凝胶电泳后,切胶回收预期大小的DNA片段。凝胶中DNA片段的回收可以使用试剂盒进行操作,例如百奥莱博的琼脂糖凝胶DNA回收试剂盒(货号:YT010)。也可以采用反复冻融等方法回收DNA片段。
- 按照T载体的说明书取适量T载体,加入3倍摩尔数的待插入片段。参考下表设置连接反应体系。
注1:很多时候由于载体量和PCR产物的量都比较少,在回收后很难定量。此时可以根据回收前电泳条带的亮度进行大致的估计。通常以DNA分子量标准的某一条带为参考,估计或通过灰度半定量您的目的条带和该参考条带的亮度的比例关系。然后再按照预计的纯化或凝胶回收时的得率计算出最终得到的载体量和PCR产物的量的比例关系。
注2:通常每个反应使用0.2~0.5μL连接酶已经足够,如果希望进一步提高连接效率,可以把连接酶的用量提高至1μL。T载体 适量 待插入片段 约载体摩尔数的3倍 10×Ligation Buffer 2μL 双蒸水或Milli-Q水 至20μL T4 DNA ligase 0.2~0.5μL 总体积 约20μL - 用移液器轻轻吹打混匀或轻微Vortex混匀,室温离心数秒,使液体积聚于管底。
- 20~25℃孵育连接1~2小时,或16℃孵育连接过夜。
注:为快速获得预期克隆可以参考如下方法:对于20μL的粘端连接反应,在连接1~2小时后可以取10μL直接转化大肠杆菌,其余10μL可以16℃孵育连接过夜。如果第二天顺利获得克隆,即可进入下一步实验;如果第二天转化的大肠杆菌未获得预期的克隆,则可以取连接过夜的剩余连接产物再次转化大肠杆菌。 - 随后即可直接取连接产物用于转化感受态细菌。
- PCR产物凝胶电泳后,切胶回收预期大小的DNA片段。凝胶中DNA片段的回收可以使用试剂盒进行操作,例如百奥莱博的琼脂糖凝胶DNA回收试剂盒(货号:YT010)。也可以采用反复冻融等方法回收DNA片段。
- Linker或RNAi片段和载体的连接:
- 载体的酶切和纯化同步骤1a和1b。
- Linker或RNAi片段的退火可以选择适当的DNA退火缓冲液,例如百奥莱博的DNA寡核苷酸退火缓冲液(货号:YT483),进行退火反应。
- 长度大于8bp的Linker或退火的RNAi片段,可以按照5:1至10:1的比例和载体进行连接反应。例如载体为0.03pmol,则插入片段可以为0.15至0.3pmol。长度小于8bp的linker,比例需调整为10:1以上。
- 除插入片段的用量外,随后按照步骤1e-1h进行。
- 载体的酶切和纯化同步骤1a和1b。
- DNA自身环化的连接:
参考步骤1e,待插入片段换成适量的水即可。其余步骤按照步骤1f-1h进行。 - 其它类型的DNA片段连接参考上述方法进行。

- 连接反应后转化效率很低或阳性克隆非常少:
- 可能感受态细菌转化效率太低,用质粒作为阳性对照同时检测感受态的转化效率。
- 可以尝试提高载体或插入片段的纯度。对于平端连接需注意适当延长连接时间。
- 可能载体酶切不够充分,用未经连接的载体转化作为阴性对照。
- 用存放DNA的溶液进行转化,作为阴性对照,检测感受态细菌是否存在问题。
- 可能感受态细菌转化效率太低,用质粒作为阳性对照同时检测感受态的转化效率。
相关搜索:T4 DNA连接酶,T4 DNA Ligase



