
产品货号:
WH0191
中文名称:
零背景快速克隆试剂盒
英文名称:
Zero-Background Fast Cloning Kit
产品规格:
20次
发货周期:
1~3天
产品价格:
询价
本试剂盒是一种阳性选择克隆系统,可以高效克隆各种PCR产物和任何具有平末端或粘性末端的DNA片段。本试剂盒对磷酸化或非磷酸化的DNA片段都有效。阳性选择载体和插入片段连接仅需5min即可获得超过95%的阳性重组克隆。由具有校正活性的聚合酶(如:Pfu Polymerase)扩增的平末端PCR产物可直接连入克隆载体。由无校正活性的聚合酶(如:Taq Polymerase)或聚合酶混合物扩增的PCR产物在连接前需用试剂盒提供的热稳定DNA平端化酶进行末端平端化(7min)即可。连接产物可直接转化常用的大肠杆菌菌株。
本试剂盒提供了一种即用型阳性选择克隆载体pLB Vector。该载体含有致死基因(内含多克隆位点),多克隆位点插入外源片段会引起基因失活,因此只有转化了重组质粒的细菌才能存活形成克隆菌落。而自身环化的pLB Vector表达致死的毒性蛋白(无外源片段插入),转化后杀死大肠杆菌细胞。这种阳性筛选策略无需蓝白斑筛选,极大地加速了克隆筛选进程。

- 使用方便:自连致死的零背景载体,无需蓝白斑筛选。
- 连接速度快:独特连接体系,5分钟快速连接≤ 3kb片段。
- 克隆高效:菌落数多,阳性率接近100%。
- 灵敏度高:可实现浓度低至0.05pmol及长至8kb片段的高效连接。
- 适用性广:包含高效平端化酶,平/粘末端产物均可连接。

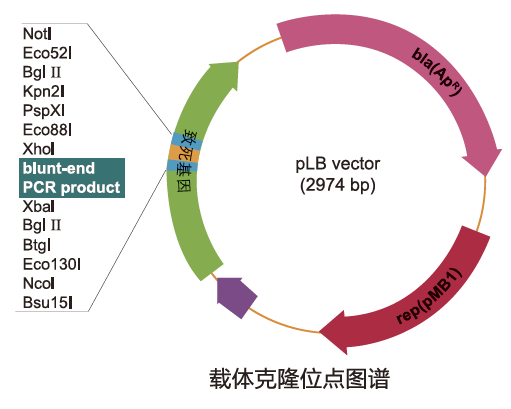
pLB Vector测序引物:
Forward Sequencing Primer,23-mer:5'-CGACTCACTATAGGGAGAGCGGC-3'
Reverse Sequencing Primer,24-mer:5'-AAGAACATCGATTTTCCATGGCAG-3'

| 组分 | 规格 |
| pLB Vector(35ng/μL) | 20μL |
| T4 DNA Ligase(3U/μL) | 20μL |
| 2×Reaction Solution | 100μL |
| Blunting Enzyme | 10μL |
| Forward Sequencing Primer(10μM) | 200μL |
| Reverse Sequencing Primer(10μM) | 200μL |
| Control Insert DNA(700bp,50ng/μL) | 10μL |
| ddH2O | 1mL |
保存:-20℃,避免反复冻融,有效期一年。

- 转化过程中使用对照片段做对照是非常必要的,在实验出现问题时可以确定原因。
- 建议留下部分连接产物,在出现问题后能迅速的补救,减少不必要的重复实验。
- 涂布用量可根据具体实验作相应调整。如转化的DNA总量较多,可取更少量转化产物涂布平板;反之,如转化的DNA总量较少,可取200~300μL转化产物涂布平板。如果预计的克隆较少,可通过离心(4000rpm,2min)后吸除部分培养液,留下适量的培养基悬浮菌体后将其涂布于一个平板中(涂布剩余的菌液可置于4℃保存,如果次日的转化菌落数过少可以将剩下的菌液再涂布新的培养板)。
不同片段使用量:
- 载体与片段的摩尔比控制在1:3~1:10,对于1kb以下的片段建议使用1:3的比例,1kb以上的片段建议使用1:7的比例。
- 请根据凝胶电泳或紫外分光光度计检测后的浓度和片段长度来计算其摩尔比。插入片段用量,可根据以下公式粗略计算:
插入片段用量ng=(3~10)× 插入片段长度 ×载体用量ng 载体长度 - 连接体系中35ng的载体,不同大小的PCR产物最佳加入量举例如下:
PCR产物长度 最佳的使用量 700bp 25ng 2000bp 165ng

以下步骤请在无菌条件下操作
一、平末端连接方法:
- 用于高保真耐热DNA聚合酶产生的具有平末端的PCR产物的克隆。
- 若由其他耐热聚合酶产生的粘性末端的PCR产物进行克隆时,请先进行平端化,详见“粘末端连接方法”。
- 本方法也适用于由限制性内切酶产生的平末端的DNA片段,连接前DNA片段应使用琼脂糖凝胶回收试剂盒进行回收,载体与片段的摩尔比参考“不同片段使用量”的介绍。
- 按照下表的内容在无菌的离心管中加入各种成分
成分 使用量 目的PCR片段 X μL pLB Vector(35ng/μl) 1μL 2×Reaction Solution 5μL T4 DNA Ligase(3U/μL) 1μL ddH2O 至10μL
轻弹离心管以混匀反应液,短暂离心3~5sec。 - 将混合反应液放置室温(22℃)反应5min。反应结束后,将离心管置于冰上,进行后续的转化反应。
注意:如果插入片段长度大于3kb,可以将反应时间最大延长至30min。
二、粘性末端连接方法:
- 用于Taq DNA Polymerase或含有Taq DNA Polymerase的混合酶产生的3′端带A的PCR产物的克隆。
- 如果PCR产物末端的结构不明确,请使用粘性末端连接方法。
- 本方法也适用于由限制性内切酶产生的5'或3'带有突出端的DNA片段,连接前DNA片段应使用琼脂糖凝胶回收试剂盒进行回收,载体与片段的摩尔比参考“不同片段使用量”的介绍。
- 按照下表的内容在无菌的离心管中加入各种成分,进行平端化反应。
成分 使用量 Insert DNA X μL 2×Reaction Solution 5μL Blunting Enzyme 0.5μL ddH2O 至8μL
轻弹离心管以混匀反应液,短暂离心3~5sec。 - 将混合反应液置于20℃反应2min,然后置于70℃反应5min,放在冰上短暂冷却。
- 向平端化的反应体系中加入下列成分
成分 使用量 pLB Vector(35ng/μL) 1μL T4 DNA Ligase(3U/μl) 1μL - 将混合反应液置于22℃反应5min。反应结束后,将离心管置于冰上,进行后续的转化反应。
注意:如果插入片段长度大于3kb,可以将反应时间最大延长至30min。
对照实验:
实验方法同粘性末端连接
- 按照下表的内容在无菌的离心管中加入各种成分,进行平端化反应。
成分 使用量 Control Insert DNA(700bp,50ng/μL) 0.5μL 2×Reaction Solution 5μL Blunting Enzyme 0.5μL ddH2O 至8μL
轻轻弹动离心管以混匀内容物,短暂离心3~5sec。 - 将混合反应液置于20℃反应2min,然后置于70℃反应5min,放在冰上短暂冷却。
- 向平端化的反应体系中加入下列成分
成分 使用量 pLB Vector(35ng/μL) 1μL T4 DNA Ligase(3U/μL) 1μL
轻弹离心管以混匀反应液,短暂离心3~5sec。 - 将混合反应液置于22℃反应5min。反应结束后,将离心管置于冰上,进行后续的转化反应。
转化:
- 制备含有氨苄青霉素终浓度100μg/ml的LB琼脂糖平板。将平板放置在37℃,至少预热20min。
- 转化
- 取部分连接产物加到50~100μL TOP10感受态细胞中(感受态细胞应刚从-70℃冰箱取出放于冰浴上,待刚刚解冻时加入连接产物,连接产物的加入量不超过感受态细胞体积的十分之一),轻弹混匀,冰浴30min(必要时请使用超螺旋质粒pUC19同步转化感受态细胞作为对照检测转化效率,将0.1ng pUC19加入另一只感受态细胞管中,其余的操作步骤与连接产物的转化步骤同步进行)。
- 将离心管置于42℃恒温90sec,取出管后立即置于冰浴中放置2~3min,其间不要摇动离心管。
- 向离心管中加入250~500μL 37℃预热的LB(不含抗生素)培养基,150rpm、37℃振荡培养45min。目的是使质粒上相关的抗性标记基因表达,使菌体复苏。
- 将离心管中的菌液混匀,吸取100μL加到含氨苄青霉素的LB固体琼脂培养基上,用无菌的弯头玻棒轻轻的将细胞均匀涂开。待平板表面干燥后,倒置平板,37℃培养12-16h。
- 取部分连接产物加到50~100μL TOP10感受态细胞中(感受态细胞应刚从-70℃冰箱取出放于冰浴上,待刚刚解冻时加入连接产物,连接产物的加入量不超过感受态细胞体积的十分之一),轻弹混匀,冰浴30min(必要时请使用超螺旋质粒pUC19同步转化感受态细胞作为对照检测转化效率,将0.1ng pUC19加入另一只感受态细胞管中,其余的操作步骤与连接产物的转化步骤同步进行)。
检测:
- 常规检测:将得到的菌落接种1~5mL LB培养基(含有终浓度为100μg/ml的氨苄青霉素)培养基,37℃摇床振荡培养过夜,保存菌种后提取质粒,应用PCR或酶切方法鉴定插入片段是否正确。
Control Insert DNA的PCR鉴定,请参考以下反应条件:温度 时间 循环数 95℃ 2min 1 94℃ 30sec 30 60℃ 30sec 72℃ 30sec 72℃ 5min 1 4℃ ∞ - - 快速检测:挑取菌落直接进行PCR检测(具体方法见分子克隆第三版)。
- 测序鉴定:使用常规或快速方法进行初步的鉴定后进行序列的测定。
反应体系:
标准体系为10μL体积,5μL的反应体系也能取得很好的效果,试剂用量减半。
相关搜索:零背景快速克隆试剂盒,零背景克隆试剂盒,零背景平末端克隆试剂盒,零背景粘性末端克隆试剂盒,Zero-Background Fast Cloning Kit



