
产品货号:
MT0053
中文名称:
无缝连接试剂盒
英文名称:
Gibson Seamless Ligation Kit
产品规格:
10T|50T
发货周期:
1~3天
产品价格:
询价
本试剂盒是一种混合酶系统,其可将任意方法线性化的载体和与其两端具有重叠区域的一个或多个PCR片段定向重组连接。该方法不依赖于T4 DNA连接酶,不受载体和目的片段的酶切位点限制,可在30分钟内实现PCR片段高效定向无缝克隆至载体的任意位置,从而获得完整的双链DNA分子。该试剂盒使用简单,只需加入合适比例的载体和PCR片段在室温孵育15~30min即可完成片段的连接。

T5外切酶可从双链DNA5'端切割形成3'突出末端,从而促进重叠区域的具有互补序列的片段进行退火。高保真DNA聚合酶可使退火的片段向3'端延伸,从而填补片段缺口。Taq DNA连接酶可封闭缺刻从而获得完整的双链DNA分子。
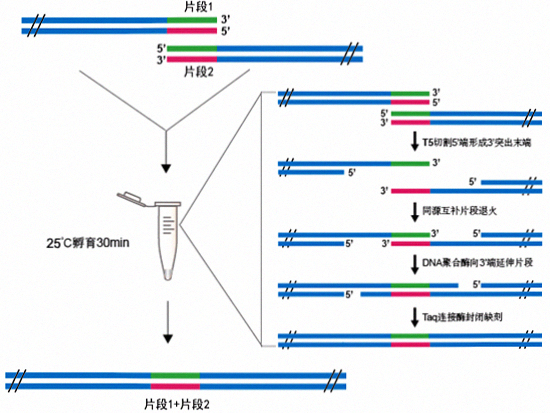

- 室温孵育即可完成片段的连接,无需50℃。
- 不受载体或插入片段酶切位点限制在任意位置进行无缝克隆。
- 不依赖于T4连接酶,高效连接,无碱基缺失。
- 可同时高效连接一个或多个PCR片段。
- 无需额外的亚克隆,菌检阳性率高达95%。

| 组分 | 10T | 50T |
| 2×Gibson Assembly Mix | 50μL | 250μL |
| 说明书 | 1份 | 1份 |
保存:-20℃,有效期2年。

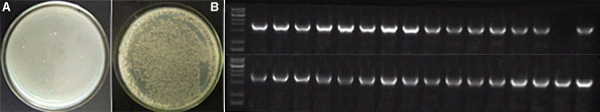
- KpnI/HindIII酶切pCold-sumo-M vector获得线性化载体,插入与载体有25nt同源臂的引物扩增Gp32基因(966bp),然后应用2×Giboson Assembly Mix连接线性化载体和Gp32,室温孵育15min,然后取5μL连接产物转化DH5a感受态细胞,涂板过夜后菌检。其中左图为长斑情况对比,A为对照(不加片段)B为实验组(Gp32片段),右图为挑取32个斑进行PCR扩增后电泳,其中阳性检出率为31/32(~97%)。
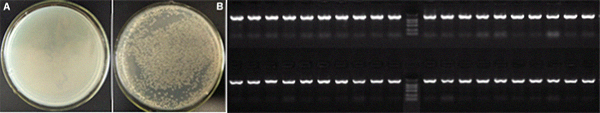
- PCR扩增pCold-sumo-M vector获得线性化载体,插入与载体有15nt同源臂的引物扩增Bsu基因(1.4kb),然后应用2×Giboson Assembly Mix连接线性化载体和Bst,室温孵育30min,然后取5μL连接产物转化DH5a感受态细胞,涂板过夜后菌检。其中左图为长斑情况对比,A为对照(不加片段)B为实验组(Bsu片段),右图为挑取40个斑进行PCR扩增后电泳,其中阳性检出率为40/40(~100%)。
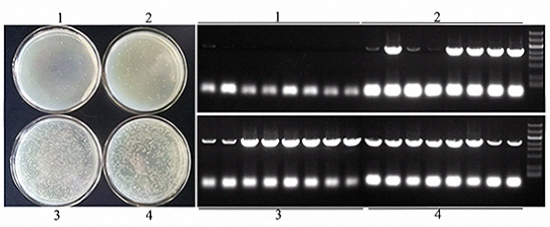
- 以单片段连接为例,载体与片段不同摩尔比对连接效率的影响。载体2742bp,片段2439bp,使用载体与片段摩尔比分别为2:1、1:1、1:2、1:3、1:4、1:5室温连接30min;片段5'和3'端与载体同源序列大小都为17bp,使用通用引物菌检,阳性条带应为2598bp。结果表明:载体与连接片段选用不同摩尔比对于菌斑数和菌检阳性率的影响较大,综合推荐摩尔比1:5。图中1~6代表载体与片段摩尔比分别为2:1、1:1、1:2、1:3、1:4、1:5。
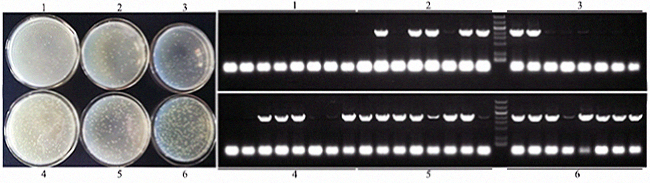
- 以单片段连接为例,不同的载体量对连接效率的影响。载体2742bp,片段2439bp,使用载体与片段摩尔比为1:5,载体用量分别为0.001pmol、0.005pmol、0.01pmol和0.015pmol室温连接30min;片段5'和3'端与载体同源序列大小都为17bp,使用通用引物菌检,阳性条带应为2598bp。结果表明:载体用量在0.01~0.015pmol之间,菌斑数和菌检阳性率较高。图中1-4分别代表载体用量为0.001pmol、0.005pmol、0.01pmol和0.015pmol。
- 多片段连接
单片段连接:载体长2742bp,片段1长2439bp,使用载体与片段摩尔比为1:5,载体用0.01pmol,室温连接30min,片段5'和3'端与载体同源序列大小都为17bp,使用通用引物菌检,阳性条带应为2598bp。
双片段连接:片段2长654bp,片段3长1802bp,载体长2742bp,载体与片段摩尔比为1:5(片段2和3皆为0.05pmol),载体用0.01pmol,室温连接30min,各片段之间的同源序列长度皆为17bp,通用引物菌检阳性条带为2598bp。
三片段连接:片段2长654bp,片段4长822bp,片段5长997bp,载体长2742bp,载体与片段摩尔比为1:5(片段2、4和5皆为0.05pmol),载体用0.01pmol,室温连接30min,各片段之间的同源序列长度皆为17bp,通用引物菌检阳性条带为2598bp。
图中1-3分别为单片段、双片段和三片段连接,A-E为PCR扩增连接所需片段,分别为片段2:654bp,片段1:2439bp,片段3:1802bp,片段5:997bp,片段4:822bp,结果表明:单片段连接的效率显著高于双片段和三片段连接,在进行双片段和三片段连接时,阳性菌检率在50%左右,可多挑取菌斑进行菌检。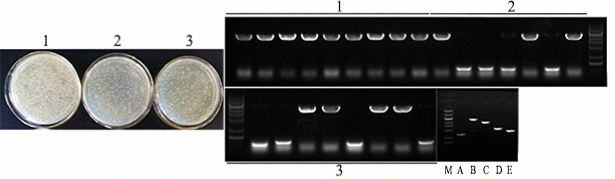

一、准备工作:
- 线性化载体制备
- 酶切获得:单酶切或双酶切均可获得线性化载体,选用的内切酶不同,载体会产生粘末端和平末端;酶切后的载体进行胶回收后再用于Gibson组装,这样有助于减少转化时因酶切不完全导致的假阳性克隆。建议使用双酶切,载体线性化完全,转化背景低。
- PCR扩增获得:建议用高保真DNA聚合酶进行PCR扩增载体片段,获得的产物建议用凝胶回收纯化以降低转化后的假阳性克隆。在以载体为模板进行PCR扩增时,模板的量应控制在0.1~0.5ng/50μL体系,从而降低转化背景。一般而言,凝胶回收后,非线性化载体已降低至一定程度,可以直接应用于Gibson组装。
- 建议通过PCR扩增获得线性化载体,这样可最大程度的降低转化背景(空载体),提高连接效率和转化阳性率。
- 酶切获得:单酶切或双酶切均可获得线性化载体,选用的内切酶不同,载体会产生粘末端和平末端;酶切后的载体进行胶回收后再用于Gibson组装,这样有助于减少转化时因酶切不完全导致的假阳性克隆。建议使用双酶切,载体线性化完全,转化背景低。
- 插入片段制备
应用BAPA HiFi DNA聚合酶进行PCR扩增获得插入片段,获得的片段如产物单一条带可进行PCR产物纯化回收,否则进行凝胶回收以提高转化效率和克隆阳性率。插入片段的引物设计尤其值得注意,具体见下一部分。 - 引物设计
插入片段的引物序列包括重叠序列部分和特异性部分。通过在引物5’端引入线性化克隆载体末端的同源序列,使得插入片段的5'和3'端分别带有与线性化克隆载体两端对应的完全一致的序列,重叠区域的长度一般为15~25nt,对于长片段可增加至40nt同源序列,特异性部分在18~25nt。- 单个插入片段的引物设计
- 线性化载体为酶切获得
根据载体线性话方式不同,其末端结构包括5'突出末端、3'突出末端和平末端三种形式,引物设计也分三种情况,示意如下: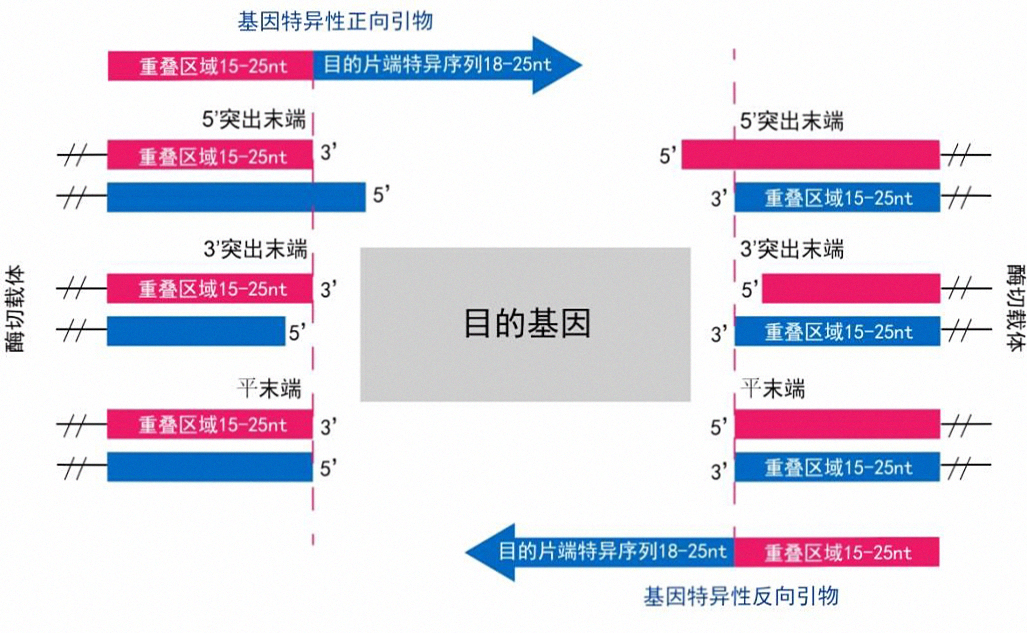
- 线性化载体由PCR扩增获得
线性化载体由反向PCR扩增获得时,要求扩增载体的PCR引物和扩增插入片段的对应PCR引物的重复序列在15~25nt之间。如只需连接一个基因,可将重复序列分配在载体和插入片段上(左图),这样引物易于优化;如需连接多个基因,为减少载体扩增次数,可将重复序列只设计在载体上(右图)。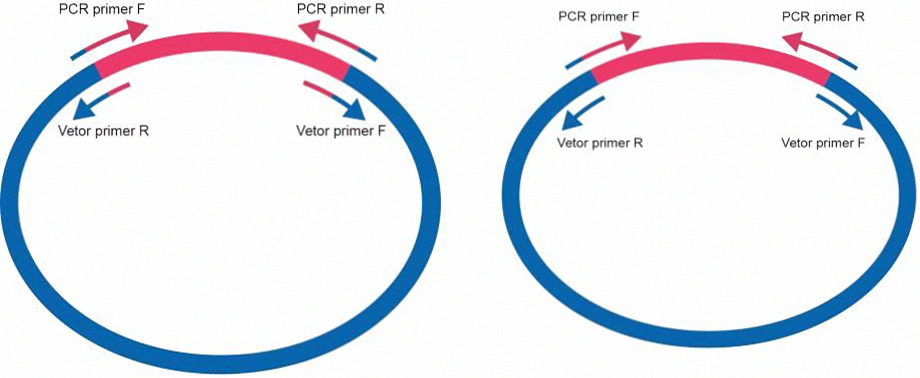
- 线性化载体为酶切获得
- 多个插入片段的引物设计
多个插入片段引物设计原理同单片段,即相邻片段之间有15~25nt的重叠区域,设计引物时有两种方式,一种为重叠区域分配在两个片段,另一种为重叠区域完全在其中一个片段上,设计如下图例: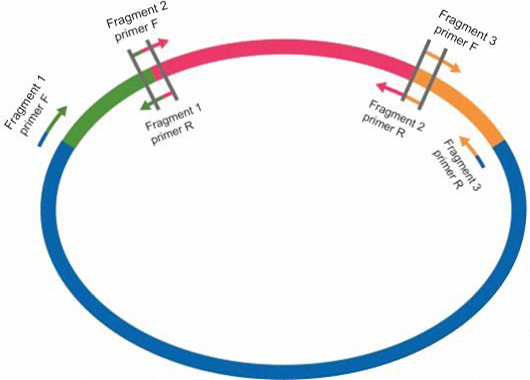
- 单个插入片段的引物设计
二、操作步骤
- 取出2×Giboson Assembly Mix,放置于室温使其完全溶化或用手捂化,融化后轻弹混匀,再短暂离心,以免有贴在管壁或管盖上的造成损失。
- 准备好线性化载体和插入片段,按照下表配制反应体系
成分 用量 线性化载体 10~50ng 插入片段 x μL 2×Giboson Assembly Mix 5μL 灭菌水 至10μL - 线性化载体一般10~50ng/10μL反应体系,插入片段与载体的摩尔比为4~5:1最佳。
- DNA片段的摩尔数算法如下:
pmols = (质量ng)×1000/(碱基数量×650)
50ng of 5000bp双链DNA片段相当于0.015pmol
50ng of 500bp双链DNA片段相当于0.15pmol
- 线性化载体一般10~50ng/10μL反应体系,插入片段与载体的摩尔比为4~5:1最佳。
- 轻轻混匀,于PCR仪上25℃孵育30min,反应产物用于转化或冻存于-20℃。对于短片段(<1kb)或1~2个片段,孵育时间可缩短至15min,对于较长片段或多片段连接,可延长孵育时间至60min,适当延长孵育时间可提高连接效果。
- 取5~10μL连接产物转化克隆感受态细胞,涂板长斑后挑菌进行菌检,挑取至少3个克隆进行测序验证。

- 无克隆长出或克隆数较少
- 引物设计不理想:根据15~25nt同源序列+18~25nt基因特异性引物原则设计优化引物,引物GC含量在40~60%之间,Tm值>50℃。
- 感受态细胞的效价过低:使用的感受态细胞效价要>106cfu/μg,操作时可设置转化质粒的实验对照,以排除因感受态细胞的效价过低引起的失败。
- 线性化克隆载体与插入片段的使用量过少或比例不佳:按照上述操作步骤中建议的量配制反应体系,载体一般使用量为10~50ng,插入片段与载体的摩尔比为4-5:1最佳,如比例严重不合适会降低转化效率。
- 线性化载体或插入片段未进行纯化抑制连接反应:线性化载体无论是酶切获得还是PCR扩增获得,都建议进行凝胶回收后在用于Gibson组装,插入片段PCR扩增后,如未经纯化,体积不要超过总反应体积的20%。
- 引物设计不理想:根据15~25nt同源序列+18~25nt基因特异性引物原则设计优化引物,引物GC含量在40~60%之间,Tm值>50℃。
- 出现较多假阳性(空载体)
- 克隆载体酶切不完全或PCR扩增时加入模板过量:未完全切开的载体会导致转化背景,即假阳性克隆,可通过提高限制性内切酶使用量、延长酶切反应时间、胶回收纯化酶切产物来降低未切开载体导致的假阳性。
- PCR扩增克隆载体时,每50μL体系模板的量控制在0.1~5ng,否则也会导致转化背景过多。
- 克隆载体酶切不完全或PCR扩增时加入模板过量:未完全切开的载体会导致转化背景,即假阳性克隆,可通过提高限制性内切酶使用量、延长酶切反应时间、胶回收纯化酶切产物来降低未切开载体导致的假阳性。
- 克隆测序后片段不正确
- PCR产物混有非特异扩增产物:建议对PCR产物进行切胶回收,保证回收的条带为正确的单一条带。
- 酶切不完全:如线性化载体时不是由空载体酶切或扩增,而是由已插入其他片段的载体酶切或扩增制备而来,酶切不完全会导致克隆中插入不正确的片段,因此提高酶切效率或使用预线性化质粒作为模板或载体凝胶回收都可降低此种情况的发生。
- PCR产物混有非特异扩增产物:建议对PCR产物进行切胶回收,保证回收的条带为正确的单一条带。
相关搜索:无缝连接试剂盒,无缝连接,无缝克隆,Gibson组装,Gibson Seamless Ligation Kit



