产品货号:
BTN160101
中文名称:
pUCm-T载体
英文名称:
pUCm-T vector
产品规格:
1μg
发货周期:
1~3天
产品价格:
询价
本产品是一种高效克隆PCR产物(TA Cloning)的专用载体。本载体由pUC系列载体改造而成,在pUC载体的多克隆位点处插入特殊的限制性内切酶识别位点,酶切后能在载体的3′端形成悬挂的“T”末端。很多DNA聚合酶在进行PCR扩增时会在PCR产物双链DNA 每条链的3′端加上一个突出的碱基A。这样,pUCm-T载体的两端就可以和PCR产物的两端进行正确的AT 配对,在连接酶的催化下,就可以把PCR产物连接到,pUCm-T载体中,形成含有目的片断的重组载体。可以通过蓝白斑筛选有插入片断的重组克隆,大大提高了3′末端A 突出PCR产物的连接、克隆效率。本产品应用于进行TA 克隆,克隆PCR产物。对克隆后的PCR产物可以用M13通用引物进行DNA 测序。
储存条件:低温运输,-20℃保存,有效期一年。
使用方法:
一. 实验准备
1. PCR产物3′末端带有突出的A碱基:Taq、Tth、Ampli Taq、Klen Taq DNA聚合酶扩增的PCR产物3′末端均带有突出的A碱基。建议扩增的PCR产物通过琼脂糖凝胶电泳进行回收,再进行连接转化实验。
2. PCR产物3′末端没有突出的A碱基:Pfu、Pwo、Tli或DeepVent等DNA聚合酶具有3′5′外切酶活性,其扩增的PCR产物末端可能不带有3′A,要对这种平末端PCR产物进行克隆,应先对其进行3′末端加A,再进行连接转化实验。
二.连接反应
3.在一个标准的10mL连接反应体系中,加入下列成分:
注意:一般最后加入T4 DNA连接酶。
4. 用移液器吹打反应混合液使之混匀后,16-23℃连接1~12小时(或按T4 DNA连接酶供货商提供的操作手册进行连接)。
三.细菌转化和鉴定
5. 将100μl感受态细胞置于冰上解冻后,完全解冻后轻轻将细胞均匀悬浮。
6. 加入上述5μl连接液,轻轻混匀,冰上放置30分钟。
7. 42℃水浴热激90秒,再冰上放置15~20分钟。
8. 加入400μl自备的SOC培养基,37℃ 200~250rpm振荡培养1小时。
9. 4000rpm离心5分钟,用枪头吸掉400μl上清液,用剩余的培养基将细胞悬浮。
10. 将细菌悬液均匀涂布在含20μl的IPTG(100mM)和100μl的X-gal(20mg/mL)的氨苄青霉素抗性的自备的LB平板上。(涂布菌液的用量可以根据连接的效率及感受态细胞的转化效率而进行适当的调整。)
11. 将平板于37℃培养1小时,然后倒置培养过夜。(先将平板正向放置1小时,以吸收过多的液体。)
四.筛选
12.转化子的蓝白筛选:
当外源DNA片段插入到pUCm-T载体中后,由于外源DNA的核酸序列存在改变了LacZ基因的编码,从而影响了其产物β-半乳糖苷酶α-片段的活性,因此重组克隆在-gal/IPTG 平板上呈现为白色,而非重组克隆呈蓝色。选择在IPTG/X-gal 平板上生长的白色菌落,用牙签挑至含氨苄青霉素的液体培养基,37℃培养过夜。
13.转化子的鉴定:
1)用上述培养的白色菌落的菌液抽提质粒,用PstI单酶切或用其它合适的酶切,琼脂糖凝胶电泳检查片段大小,确定是否含有目的片段。
2)用M13通用引物或其它合适的引物直接进行测序来确定是否含有目的克隆。
操作提示:
1. PCR产物的纯度:
连接反应前需用琼脂糖凝胶电泳检测PCR反应产物,如果电泳检测PCR产物条带弥散,或出现非特异条带,则需要切下目的条带,用胶回收试剂盒对目的片段进行回收。若PCR产物电泳检测只有预期大小的明显条带,也应使用PCR产物纯化试剂盒直接纯化PCR产物,以除去引物二聚体。不经纯化的PCR产物在某些条件下可直接用于连接,但由于引物二聚体和PCR产物中其它物质的影响,造成含有插入片段的阳性克隆数减少,因而需要筛选很多克隆方可得到含有目的PCR产物的阳性克隆。
2. 平端PCR产物
具有校正活性的热稳定性DNA聚合酶如Pfu、Pwo、Tli在进行PCR扩增时产生平端PCR产物。这种平端PCR产物可以进行3′末端加A 尾后连接到pUCm-T载体中,采用这种方法进行连接,可大大提高克隆的效率。
3.优化插入片段和载体的摩尔比
1)pUCm-T载体优化的插入DNA片段和载体的摩尔比为3:1,采用3-10:1的连接比例也可成功进行连接。如果你的PCR产物开始连接的不理想,则有必要优化连接比例。
2)PCR产物的量可采用以下公式进行换算:
PCR片段的量(ng)= [加入载体的量(ng)×插入片段大小(kb)/载体大小(kb)]×插入片段和载体的摩尔比
4.筛选含插入片段的转化子
插入片段成功克隆到pUCm-T载体中,可阻断β-半乳糖苷酶的编码序列,因而重组克隆可在指示培养基上通过颜色进行筛选。大多数情况下含有PCR产物的克隆菌为白色,如果PCR片段和LacZ基因在同一读码框内,即PCR片段碱基数是3的整数倍(含3′-A),并且读码框无终止密码子,则重组克隆菌可能为蓝色。
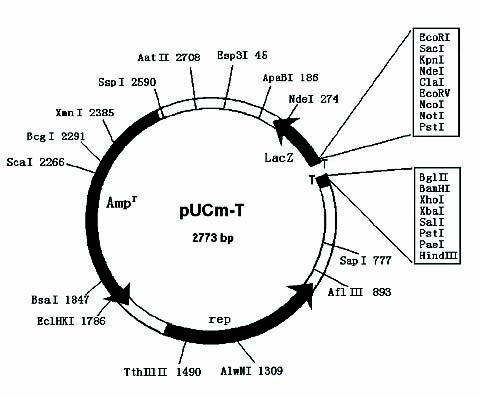
质粒图谱:
相关搜索:pUCm-T载体,pUCm-T vector
储存条件:低温运输,-20℃保存,有效期一年。
使用方法:
一. 实验准备
1. PCR产物3′末端带有突出的A碱基:Taq、Tth、Ampli Taq、Klen Taq DNA聚合酶扩增的PCR产物3′末端均带有突出的A碱基。建议扩增的PCR产物通过琼脂糖凝胶电泳进行回收,再进行连接转化实验。
2. PCR产物3′末端没有突出的A碱基:Pfu、Pwo、Tli或DeepVent等DNA聚合酶具有3′5′外切酶活性,其扩增的PCR产物末端可能不带有3′A,要对这种平末端PCR产物进行克隆,应先对其进行3′末端加A,再进行连接转化实验。
二.连接反应
3.在一个标准的10mL连接反应体系中,加入下列成分:
| 反应组分 | 10μl反应体系 |
| 插入的目的片段 | xμL(0.2 pmol) |
| 本产品 | 1μL(50 ng) |
| 10×连接酶缓冲液 | 1μL |
| T4 DNA连接酶 | 3-5 U |
| 补水到 | 10 L |
注意:一般最后加入T4 DNA连接酶。
4. 用移液器吹打反应混合液使之混匀后,16-23℃连接1~12小时(或按T4 DNA连接酶供货商提供的操作手册进行连接)。
三.细菌转化和鉴定
5. 将100μl感受态细胞置于冰上解冻后,完全解冻后轻轻将细胞均匀悬浮。
6. 加入上述5μl连接液,轻轻混匀,冰上放置30分钟。
7. 42℃水浴热激90秒,再冰上放置15~20分钟。
8. 加入400μl自备的SOC培养基,37℃ 200~250rpm振荡培养1小时。
9. 4000rpm离心5分钟,用枪头吸掉400μl上清液,用剩余的培养基将细胞悬浮。
10. 将细菌悬液均匀涂布在含20μl的IPTG(100mM)和100μl的X-gal(20mg/mL)的氨苄青霉素抗性的自备的LB平板上。(涂布菌液的用量可以根据连接的效率及感受态细胞的转化效率而进行适当的调整。)
11. 将平板于37℃培养1小时,然后倒置培养过夜。(先将平板正向放置1小时,以吸收过多的液体。)
四.筛选
12.转化子的蓝白筛选:
当外源DNA片段插入到pUCm-T载体中后,由于外源DNA的核酸序列存在改变了LacZ基因的编码,从而影响了其产物β-半乳糖苷酶α-片段的活性,因此重组克隆在-gal/IPTG 平板上呈现为白色,而非重组克隆呈蓝色。选择在IPTG/X-gal 平板上生长的白色菌落,用牙签挑至含氨苄青霉素的液体培养基,37℃培养过夜。
13.转化子的鉴定:
1)用上述培养的白色菌落的菌液抽提质粒,用PstI单酶切或用其它合适的酶切,琼脂糖凝胶电泳检查片段大小,确定是否含有目的片段。
2)用M13通用引物或其它合适的引物直接进行测序来确定是否含有目的克隆。
操作提示:
1. PCR产物的纯度:
连接反应前需用琼脂糖凝胶电泳检测PCR反应产物,如果电泳检测PCR产物条带弥散,或出现非特异条带,则需要切下目的条带,用胶回收试剂盒对目的片段进行回收。若PCR产物电泳检测只有预期大小的明显条带,也应使用PCR产物纯化试剂盒直接纯化PCR产物,以除去引物二聚体。不经纯化的PCR产物在某些条件下可直接用于连接,但由于引物二聚体和PCR产物中其它物质的影响,造成含有插入片段的阳性克隆数减少,因而需要筛选很多克隆方可得到含有目的PCR产物的阳性克隆。
2. 平端PCR产物
具有校正活性的热稳定性DNA聚合酶如Pfu、Pwo、Tli在进行PCR扩增时产生平端PCR产物。这种平端PCR产物可以进行3′末端加A 尾后连接到pUCm-T载体中,采用这种方法进行连接,可大大提高克隆的效率。
3.优化插入片段和载体的摩尔比
1)pUCm-T载体优化的插入DNA片段和载体的摩尔比为3:1,采用3-10:1的连接比例也可成功进行连接。如果你的PCR产物开始连接的不理想,则有必要优化连接比例。
2)PCR产物的量可采用以下公式进行换算:
PCR片段的量(ng)= [加入载体的量(ng)×插入片段大小(kb)/载体大小(kb)]×插入片段和载体的摩尔比
4.筛选含插入片段的转化子
插入片段成功克隆到pUCm-T载体中,可阻断β-半乳糖苷酶的编码序列,因而重组克隆可在指示培养基上通过颜色进行筛选。大多数情况下含有PCR产物的克隆菌为白色,如果PCR片段和LacZ基因在同一读码框内,即PCR片段碱基数是3的整数倍(含3′-A),并且读码框无终止密码子,则重组克隆菌可能为蓝色。
质粒图谱:

相关搜索:pUCm-T载体,pUCm-T vector



