

本制品是一种基于钙黄绿素(Calcein-AM)和碘化丙啶(PI)的双荧光染色法快速、便捷地检测3D培养的细胞球或类器官中活细胞和坏死细胞的试剂盒。仅需染色10分钟,就可在荧光显微镜下观察到非常明亮的活细胞绿色荧光染色和坏死细胞中非常明亮的细胞核红色荧光染色。本试剂盒适用于荧光显微镜、荧光酶标仪及其它荧光检测系统。
Calcein AM是一种可以对活细胞进行荧光染色的细胞染色试剂,Calcein AM是在Calcein (钙黄绿素)的基础上增加了乙酰氧基甲酯(AM)基团,加强了疏水性,因此能够很容易穿透细胞膜。Calcein AM本身并没有荧光,进入细胞后被活细胞中内源性酯酶水解生成具有强负电荷的不能通透细胞膜的极性分子钙黄绿素(Calcein),从而被滞留在细胞内,而Calcein可发出强绿色荧光。由于死细胞缺乏酯酶或酯酶活性很低,Calcein AM进入细胞后含有酯酶的活细胞可以产生Calcein,而死细胞不能或很少能产生Calcein,因此仅活细胞会被染色为强绿色荧光,死细胞不能被染色或者染色非常弱。核酸红色荧光染料碘化丙啶(PI)由于不能穿透活细胞的细胞膜,而只能染色细胞膜完整性被破坏的死细胞。因此,Calcein AM与碘化丙啶联合使用,对活细胞和死细胞同时进行双重荧光染色,就能用于细胞活性与细胞毒性的检测。Calcein AM水解产物Calcein的最大激发光波长为494nm,最大发射光波长为517nm;PI-DNA复合物的最大激发光波长为535nm,最大发射光波长为617nm。百奥莱博同时提供Calcein-AM、PI和Hoechst 33342三荧光的3D细胞活力检测试剂盒(Calcein/PI/Hoechst33342)。

- 适用范围广:本试剂盒可用于常规方法培养出的3D细胞球或类器官,包括超低吸附细胞培养板、Matrigel包被的平板、琼脂糖包被的平板、细胞悬滴培养板等。
- 使用便捷:整个检测过程仅需约10~30分钟即可完成。3D细胞球经坏死等诱导处理后,仅需将本试剂盒中的By3D Calcein AM染色液(100×)和By3D PI染色液(100×)用检测缓冲液按照比例配制后避光孵育10分钟,就可进行后续的荧光显微镜拍照或者荧光酶标仪定量等荧光检测和分析。

| 组分 | 100T | 500T |
| By3D Calcein AM染色液(100×) | 100μL | 500μL |
| By3D PI染色液(100×) | 100μL | 500μL |
| 检测缓冲液 | 10mL | 50mL |
保存:-20℃,避光,有效期1年。

- 本试剂盒反复冻融可能会降低染色效果,为保证最佳使用效果,请尽量避免反复冻融,第一次解冻后可以适当分装保存。
- 细胞球在外力的作用下容易变形或分散,固定、PBS洗涤及换液等过程须轻缓,避免破坏或吹散3D细胞球。
- 不同种类的细胞球对凋亡或坏死诱导剂的耐受可能存在一定的差别,3D细胞球经凋亡或坏死诱导后,形态可能会发生一些变化,在染色前可以镜下观察细胞球的形态,可以酌情考虑是否选择形态比较完整的细胞球进行染色分析。
- 荧光染料都存在淬灭的问题,建议染色后尽量当天完成检测。
- By3D Calcein AM染色液(100×)在潮湿环境中容易分解,首次使用时建议适当分装并-20℃密封保存。
- 由于Calcein AM在水溶液中不稳定,By3D Calcein AM/PI检测工作液须现配现用,不能配制后冻存。
- 培养液中的血清和酚红对Calcein AM的染色可能有一定的影响,使荧光背景增强,建议在加入By3D Calcein AM/PI检测工作液前适当洗涤细胞。

本步骤以96孔板,每孔接种100μL细胞为例,如使用其它类型的多孔板,各试剂使用量请按照相应比例进行换算。
- 3D细胞的准备:在96孔3D培养板中每孔接种100μL细胞,细胞的接种量根据具体的实验方案,例如培养天数、需要的3D细胞球状体的大小等确定,按照3D细胞培养方案培养细胞,并按照实验设计进行一定的处理。96孔3D培养板推荐使用3D细胞培养板包被液、3D细胞培养包被试剂盒包被的U形底96孔板,或直接使用GoldBalb超低吸附96孔板(YTC4962或YTC4961)、超低吸附黑色透明底96孔板等。
- 为达到最佳的染色效果,具体的细胞球培养时间、药物等干预时间可以根据细胞种类、具体的实验需求等进行调整。例如,对于HCT-116细胞,通常接种培养48小时形成较为紧实的细胞球后进行干预和染色效果较好。
- 3D细胞Calcein AM/PI染色:
- By3D Calcein AM/PI检测工作液的用量:对于6、12、24、96孔板,每孔By3D Calcein AM/PI检测工作液的用量分别为0.5~1mL、200~500μL、100~200μL和50~100μL。
- By3D Calcein AM/PI检测工作液的配制:如下表所示,按照每孔需要100μL By3D Calcein AM/PI检测工作液的量,用检测缓冲液稀释配制适量的By3D Calcein AM/PI检测工作液。
样品数 10个 50个 100个 By3D Calcein AM染色液(100×) 10μL 50μL 100μL By3D PI染色液(100×) 10μL 50μL 100μL 检测缓冲液 0.98mL 4.9mL 9.8mL By3D Calcein AM/PI检测工作液 1mL 5mL 10mL - 配制好的By3D Calcein AM/PI检测工作液必须一次使用完毕,不能冻存。
- By3D Calcein AM/PI检测工作液中的Calcein AM和PI的最终浓度可以根据不同细胞系和实验体系通过预实验进行优化。Calcein AM和PI的工作浓度一般为0.5~2×,推荐使用浓度为1×。
- 染色:小心吸除原有细胞培养液,沿着孔壁缓慢加入适量的PBS洗涤细胞球1次,沿着孔壁缓慢加入100μL By3D Calcein AM/PI检测工作液,在适宜于细胞培养的温度避光孵育10分钟。
- 为达到最佳的染色效果,具体染色时间可以根据细胞种类、培养天数、细胞球状大小等进行调整。
- 任何液体吸除或加入的过程须轻缓,避免破坏或吹散3D细胞球。3D细胞球通常位于在培养板或培养皿等培养器皿的底部,培养板在对着光线时能看到孔内针尖大小的乳白色细胞球,吸除孔内液体时须尽量避开细胞球以免将细胞球吸走。可以根据孔内液体的体积将移液器调至合适的量程,例如需要吸除的液体体积为100μL,将200μL移液器的量程调整到50~70μL,避开细胞球从液体边缘缓慢、分次吸除。孔内加入液体时,沿着孔壁小心、缓慢加入,避免破坏或吹散3D细胞球。
- By3D Calcein AM/PI检测工作液的用量:对于6、12、24、96孔板,每孔By3D Calcein AM/PI检测工作液的用量分别为0.5~1mL、200~500μL、100~200μL和50~100μL。
- 荧光检测:
- 荧光显微镜检测:染色结束后,小心去除孔内染色液,沿着孔壁缓慢加入适量的PBS洗涤细胞球1次并更换为完全培养液,随后即可在荧光显微镜下观察。
- 任何液体吸除或加入的过程须轻缓,避免破坏或吹散3D细胞球。
- 荧光酶标仪检测:
- 3D细胞培养和处理同前。
- 孵育结束后,用荧光酶标仪检测(Calcein AM为绿色荧光,Ex/Em=494/517nm;PI为红色荧光,Ex/Em=535/617nm)。通过对比对照组与处理组的RFU,可以计算出死细胞与活细胞的相对比例关系。
- 任何液体吸除或加入的过程须轻缓,避免破坏或吹散3D细胞球。
- 3D细胞培养和处理同前。
- 荧光酶标仪检测细胞死活比例更精细的方法。本方法通过设置对照,可更精细地计算出死细胞与活细胞的比例。
- 3D细胞培养和处理同前。
- 除配制By3D Calcein AM/PI检测工作液外,还需要配制单独的By3D Calcein AM检测工作液和PI检测工作液用于对照的检测。配制方法和稀释倍数与By3D Calcein AM/PI检测工作液的配制一致。
- 检测样品组和对照组设置:
- 对于下面组别的细胞或无细胞组,需要保持细胞数量、检测工作液浓度、孵育时间和孵育温度的完全一致。
编号 组别 检测工作液 激发波长 发射波长 结果命名 (1) 样品组 By3D Calcein AM/PI 494nm 517nm F(517)sam (2) 样品组 By3D Calcein AM/PI 535nm 617nm F(617)sam (3) 活细胞组 By3D PI 494nm 517nm F(517)min (4) 活细胞组 By3D Calcein AM 494nm 517nm F(517)max (5) 死细胞组 By3D PI 535nm 617nm F(617)max (6) 死细胞组 By3D Calcein AM 535nm 617nm F(617)min (7) 无细胞组 By3D Calcein AM/PI 494nm 517nm F(517)0 (8) 无细胞组 By3D Calcein AM/PI 535nm 617nm F(617)0 - 活细胞组为没有加入药物处理的细胞;死细胞组可用0.1~0.5%洋地黄皂苷或0.1%皂素处理细胞10分钟,或70%乙醇孵育细胞30分钟即可得到死细胞。
- 染色和检测步骤同前。
- 根据检测数据计算死细胞与活细胞的比例:
% 3D Live Cells = F(517)sam-F(517)min ×100% F(517)max-F(517)min % 3D Dead Cells = F(617)sam-F(617)min ×100% F(617)max-F(617)min - 其中所有的F(517)和F(617)都减去相应的F(517)0和F(617)0。
- 如果需要确定活细胞与死细胞的具体数量,可制作不同数量活细胞与死细胞在517nm和617nm处的荧光光谱标准曲线。该标准曲线呈线性关系,因此通过标准曲线和样品中两个染料的荧光强度可计算出活细胞与死细胞的数量。
- 3D细胞培养和处理同前。
- 荧光显微镜检测:染色结束后,小心去除孔内染色液,沿着孔壁缓慢加入适量的PBS洗涤细胞球1次并更换为完全培养液,随后即可在荧光显微镜下观察。

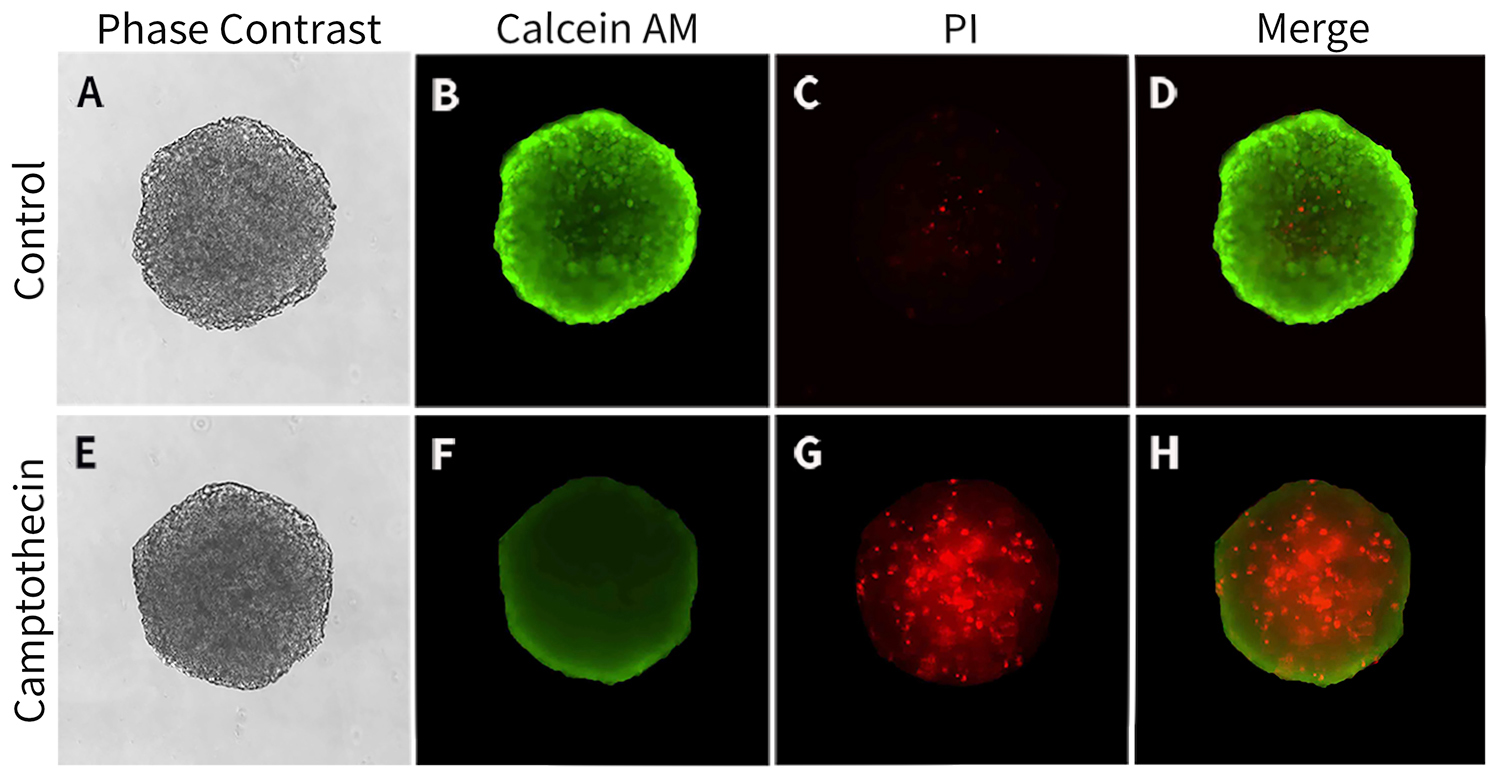
图1.本试剂盒对于3D培养的HCT-116细胞的染色效果图。5000个HCT-116细胞在使用3D细胞培养包被试剂盒包被的U形底96孔板中培养48小时,100μM Camptothecin诱导细胞球凋亡、坏死过夜,洗涤细胞球一次后加入1×的By3D Calcein AM/PI检测工作液,染色10分钟。结果显示,By3D Calcein/PI细胞活性与细胞毒性检测试剂盒对于药物诱导坏死后的3D细胞染色效果清晰、明亮,Calcein AM染色的活细胞染色可见明显差别(B、F),PI染色的3D细胞球内部坏死更严重一些(G、H),同时Control组无明显PI荧光染色(C、D)。实际检测效果会因细胞株、实验条件、检测仪器等的不同而存在差异,图中效果仅供参考。

传统的细胞培养大多以二维(2D)的形式展开,但2D培养的细胞在生长方式、生长形态、分化和功能等方面都与体内生理条件下细胞的真实形态和结构存在明显差异,可能会因为细胞结构和组织形态的缺失,使实验结果的可信度降低。三维(3D)细胞培养能够更好地模拟体内细胞生存的微环境,更能代表体内组织,也能更真实的反应细胞与细胞间、细胞与基质间的相互作用,细胞对外源性和内源性刺激的应答也更接近于它们在体内的反应,3D细胞培养从而成为更有价值并更为可信的体外实验模型,能够获得与体内实验更加一致的实验结果。
相关搜索:3D培养活细胞与坏死细胞检测试剂盒(Calcein/PI),细胞活性与细胞毒性检测



